|
Unités ; radioactivité ; IR et RMN ; sécurité ; polarité des solvants; analyse thermique concours assistant d'ingénieur 2006 Rhone, Auvergne |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Radioactivité 3 pts. L'élément iode I possède des nucléides isotopes radioactifs utilisés en médecine. Leurs période radioactive en heures (h) et en jours (j) est : 131I : 8 j ; 123I : 13 h. Quel isotope choisiriez-vous pour la détection du fonctionnement de la thyroïde. Justifier. Choisir l'isotope 123I de courte période pour une scintigraphie afin que ce dernier disparaisse de l'organisme assez rapidement. ( au bout de 5 ou 6 période, soit quelques jours) Il faut aussi prendre en compte le coût de l'isotope. Sachant que l'on fait ingérer au malade 1 mg d'iode, déterminez la masse du radionucléide présente dans le corps au bout de quatre périodes. Au bout d'une période, il reste 0,5 mg d'iode. Au bout de 2 périodes, il reste 0,25 mg d'iode. Au bout de 3 périodes, il reste 0,125 mg d'iode. Au bout de 4 périodes, il reste 0,0625 mg d'iode.
En radioprotection, la nocivité radioactive s'exprime en équivalent de dose (E.D). Quelle est l'unité de cet E.D ? Est-il fonction du rayonnement radioactif émis ? Lorsqu'un rayonnement pénètre la matière, il interagit avec celle-ci et lui transfert de l'énergie. La dose absorbée par la matière caractérise ce transfert d'énergie. L'unité de dose absorbée par la matière est le Gray ( Gy) qui est l'équivalent d'un joule absorbé par kilogramme de matière. Tous les rayonnements n'ayant pas la même nocivité on définit un équivalent de dose dans lequel chaque type de rayonnement doit être pondéré pour tenir compte des différences. L'unité d'équivalent de dose est le sievert ( Sv). Un composé organique de formule brute
CxHyOz
conduit à l'analyse
élémentaire suivante : C : 69,7 % ; H : 11,7 %. Le spectre de masse de ce composé
présente en impact électronique un
ion moléculaire à m/e =86. Déterminer la
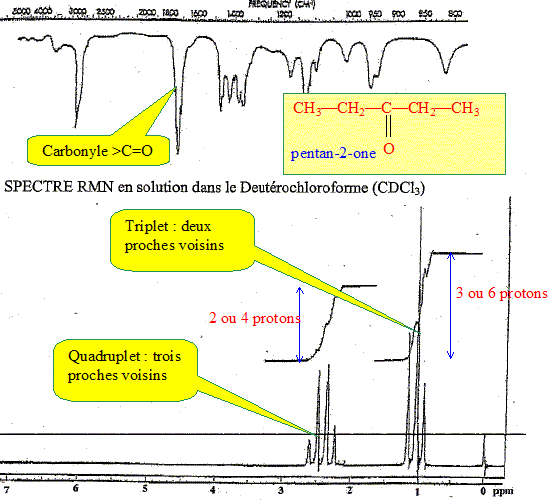
formule brute de ce composé. Masse molaire M= 86 g/mol. 12 x/ 69,7 = 86/100 soit x = 0,86*69,7/12 = 5. y/11,7 = 0,86 soit y = 0,86*11,7 = 10 %O : 100-69,7-11,7 = 18,6% ; 16z/18,6 = 0,86 soit z = 0,86*18,6/16 = 1 C5H10O. On donne les spectres IR et RMN de ce composé : Proposez une formule semi-développée et donnez son nom.
Pratiques de laboratoire et sécurité 5 pts. Quels sont les différents types d'extincteurs présents dans un laboratoire ? Les feux sont classés en 4 classes: A : feux de
solides ; B : feux de liquides ; C : feux de gaz ; D : feux
de métaux. On y ajoute les feux d'origine
électrique E.
devant un collègue ayant les vétements
en feu : le couvrir d'une couverture pour
étouffer le feu.
Absence de flamme : les solvants sont inflammables.
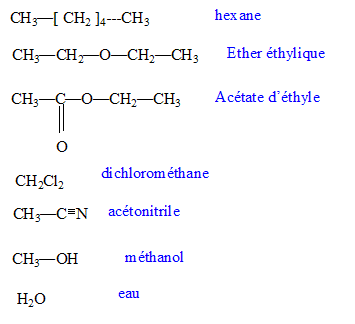
Vous disposez des solvants suivants : acétate d'éthyle, acétonitrile, dichlorométhane, eau, éther éthylique, hexane, méthanol. Donnez leurs formules semi-développées. Classez les par ordre de polarité croissante.
Expliquez en quelques mots les acronymes ATG et DSC. Décrivez ces méthodes. ATG : analyse thermique gravimétrique. Mesure des variations de masse d'un échantillon au cours de son chauffage. Balance de précision placée dans un four dont la température augmente linéairement en fonction du temps. DSC : differential scanning calorimetry ; calorimétrie différentielle à balayage Mesure les différences des échanges de chaleur entre un échantillon à analyser et une référence. On enregistre en fonction de la température la différence d'énergie absorbée entre une substance et un corps de référence, tous deux soumis à la même augmentation de température. Chromatographie d'exlusion stérique. Décrivez briévement le principe : But : mesure des masses molaires moyennes des polymères La séparation des macromolécules est basée sur leur taille. Les colonnes sont remplies de billes poreuses : les petites molécules sont retenues tandis que les plus grossest éluent assez rapidement. Détecteurs : viscosimètres, photomètres. Solvants : THF, toluène. Structure et chiralité : Donnez la formule brute de la molécule suivante :
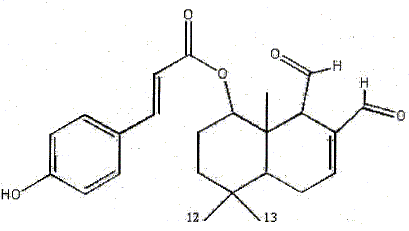
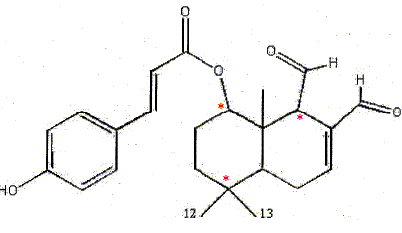
C24 H28O5. Combien y a t-il de centres d'asymétrie ? carbone tétragonal relié à 4 substituants différents. 3 centres d'asymétrie donc 23 isomères théoriques.
Quelles sont les valeurs approchées des déplacements chimiques des protons aromatiques ? déblindage vers les champs faibles : d =7,2. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||