|
Synthèse d'un isomère de l'acide 2,4-diméthyl-3-hydroxypentanoïque concours CNRS 2003, Nord, Ouest, Ile de France |
|||||
|
|||||
|
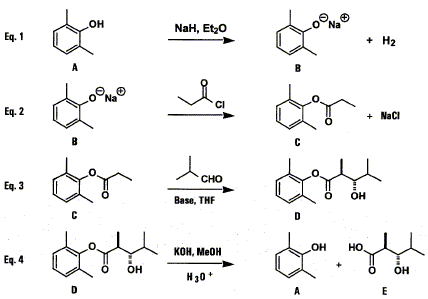
Quels sont les risques associés à la manipulation de NaH ? L'étiquette porte le pictogramme : incendie ; effets corrosifs ; intoxication ; effets néfastes pour l'environnement. Quels sont les risques associés à la manipulation du 2,6-diméthylphénol ? L'étiquette porte les pictogrammes :
incendie ; effets corrosifs ; intoxication ; effets néfastes pour l'environnement.
Quelles précautions prendriez-vous en conséquence ? port d'une blouse ; port de gants adaptés ; port de lunette de sécurité ; travail sous sorbone ; travail avec écran de sécurité ; port d'un appareil respiratoire isolant.
Quelles
précautions envisagez-vous pour le
dispositif expérimental
? - adapter un brûleur pour mesurer le
dégagement gazeux - travailler à -78 °C - mettre le dispositif
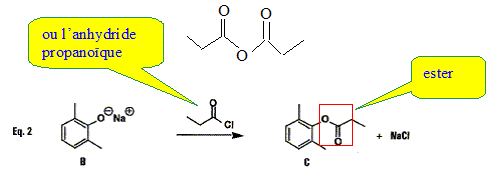
sous atmosphèe inerte - travailler à l'air libre - avec les solvants non chlorés - avec les solvants chlorés - avec les bases - avec les acides - à l'évier. Quelle est la fonction chimique du composé organique C isolé lors de la deuxième étape ? Proposez une autre méthode de synthèse de ce composé.
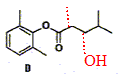
La transformation C-->D conduit majoritairement à l'isomère anti du composé D représenté dans l'équation 3. Il se forme aussi en très faible quantité l'isomère syn. Dessinez sa formule semi-développée.
Quelle(s) technique(s) d'analyse permet(tent) de mesurer les proportions de ces diastéréoisomères formés ? infrarouge ; RMN ; HPLC ; spectrométrie UV.
Quel est le principe de la réaction et du traitement ? L' hydrolyse basique ( saponification ) de l'ester conduit à un phénol et à un ion carboxylate. Le passage en milieu acide ( pH inférieur au pKa ) conduit à l'acide carboxylique.
Quelle est la masse de substrat engagée ? Masse molaire du substrat : M=15*12+22+3*16 = 250 g/mol masse (g) = quantité de matière (mol) * masse molaire (g/mol) m= 0,5*250
= 125
g.
Quelle est la masse de KOH engagée ? 4 équivalents d'hydroxyde de potassium corespond à 4*0,5 = 2 moles de KOH masse molaire KOH : M= 39+16+1 = 56 g/mol masse : 56*2 = 112 g.
Quel est le nombre de moles correspondant ? Quel est le rendement ? masse molaire de l'acide : M= 7*12+14+3*16 = 146 g/mol quantité de matière (mol) = masse (g) / masse molaire (g/mol) n = 58,4 / 146 = 0,4 mol Quantité de matière théorique d'acide : 0,5 mol rendement = 100 * quantité expérimentale / quantité théorique = 0,4*100 / 0,5 = 80 %.
|
|||||
|
|
|||||
|
|