|
concours électroradiologie médicale dosage du vinaigre. Tours 2007 |
|||
|
|||
|
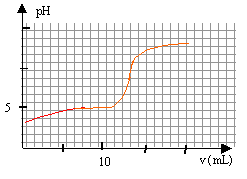
On prépare V=200 mL d'une solution de vinaigre diluée 10 fois. Puis on prélève un volume V1= 10,0 mL de solution diluée que l'on verse dans un becher, auquel on ajoute 60 mL d'eau distillée pour immerger correctement la sonde du pHmètre. On réalise le titrage avec une sloution de soude ( hydroxyde de sodium) de concentration c2= 0,100 mol/L. Cette solution est placée dans une burette graduée et le pH est relevé en fonction du volume V2 de solution de soude versé. On obtient la courbe suivante : Données : les solutions sont à 25°C ; CH3-COOH / CH3-COO- pKa = 4,8. Aide aux calculs : 104,8 = 6,3 104 ; 10-4,8 = 1,6 10-5; 109,2 = 1,6 109 ; 10-9,2 = 6,3 10-10.
A. Dilution du vinaigre : On dispose de la verrerie suivante : Eprouvette graduée 5, 10, 20, 50, 100 mL. Pipette jaugée 1,0, 2,0, 5,0, 10,0, 20,0 mL. Fioles jaugées 50,0, 100,0, 200,0, 250,0 mL Choisir la verrerie la plus appropriée pour réaliser la dilution et justifier. Solution initiale : Quel matériel doit-on utiliser pour préparer la solution initiale dans le becher ? Quel est le pH initial de la solution ? Quelle est l'espèce qui prédomine CH3-COOH ou CH3-COO- ; justifier. Réaction support du titrage : Ecrire l'équation de la transformation support du titrage. Exprimer le quotient de réaction Qr. Que devient ce quotient dans l'état d'équilibre du système ? Calculer sa valeur. Cette valeur dépend t-elle de la composition initiale du système ? Quelles hypothèses faut-il faire sur la transformation chimique pour que la réaction puisse servir de support du dosage ? Etude de l'équivalence ; concentration du vinaigre : Déterminer graphiquement les coordonnées du point d'équivalence. On note n1 la quantité de matière du réactif titré innitialement apporté dans le becher et n2 E la quantité de matière du réactif titrant versé à l'équivalence. Etablir la relation reliant n1 et n2 E. En déduire la concentration c1 en acide éthanoïque dans la solution diluée, puis la concentration c en acide éthanoïque dans le vinaigre. Titrage colorimétrique : On souhaite doser d'autre vinaigre en utilisant une méthode colorimétrique. On dispose des indicateurs colorés suivants : rouge de méthyle : zone de virage [4,2 ; 6,2] ; bleu de bromophénol : zone de virage [3,0 ; 4,6 ] ; rouge de crésol : zone de virage :[7,2 ; 8,8].Quel est l'indicateur ( quels sont les indicateurs) qu'il ne faut pas utiliser ? Pourquoi ? Quel est l'intérêt de cette méthode ?
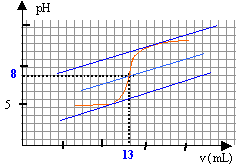
A. Dilution du vinaigre : Fiole jaugée de 200,0 mL. Le facteur de dilution est égal à F=10: utiliser la pipette jaugée de 200 / 10 = 20,0 mL Solution initiale : Pour préparer la solution initiale dans le becher, le volume d'eau ( peu précis ) est mesuré à l'aide d'une éprouvette graduée de 100 mL et le volume V1= 10,0 mL de solution diluée est prélevé à l'aide d'une pipette jaugée de 10,0 mL. pH initial de la solution : D'après le graphe, le pH initial est voisin de 3,5. A pH inférieur à pKa, la forme acide CH3-COOH du couple acide base prédomine. Réaction support du titrage : Equation de la transformation support du titrage. CH3COOH + HO- = CH3COO- + H2O Quotient de réaction Qr. Qr= [CH3-COO-] / ([CH3COOH ][HO-]) Dans l'état d'équilibre du système ce quotient vaut : Qr éq= [CH3-COO-]éq [H3O+]éq / ([CH3COOH ]éq[HO-]éq[H3O+]éq) Qr,éq=10-4,8 / 10-14 = 109,2 = 1,6 109. Le quotient de réaction dans l'état d'équilibre d'un système Qr,éq prend une valeur indépendante de la composition initiale, qui est la constante d'équilibre associée à l'équation de la réaction. Les réaction acide base sont rapides, l'équilibre est très vite atteint. La valeur précédente Qr,éq est grande, la transformation est totale et peut servir de support à la réaction du dosage. Etude de l'équivalence ; concentration du vinaigre :
A l'équivalence les quantités de matière d'acide et de base sont stoéchiométriques. Avant l'équivalence l'acide est en excés, après l'équivalence la base est en excès. n1 = V1C1 = 0,01 C1. n2,éq = V2,éq C2 = 0,013*0,1 = 1,3 10-3 mol n1 =n2,éq = 1,3 10-3 mol 1,3 10-3 = 0,01 C1 d'où C1 = 1,3 10-3 / 0,01 = 0,13 mol/L le vinaigre est dix fois plus concentré : 1,3 mol/L. Titrage colorimétrique : La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent : seul le rouge de crésol (zone de virage :[7,2 ; 8,8] ) convient. Intérêt de cette méthode : plus rapide ; elle ne nécessite pas l'utilisation d'un pHmètre coûteux.
|
|||
|
|