|
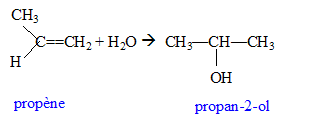
hydratation du propène ; oxydation par l'ion dichromate concours technicien laboratoire 2007 |
|||
|
|||
La règle de Markovnikov permet de prévoir sur quel atome de carbone se fixe l'hydrogène de l'hydracide ( ou de H2O) : l'atome d'hydrogène se fixe sur l'atome de carbone le moins substitué ( formation du carbocation le plus stable ).
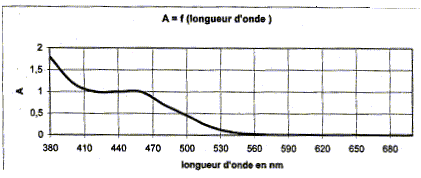
- En utilisant le graphique justifier la couleur d'une solution aqueuse de dichromate de potassium. - Quelles précautions prendre pour manipuler les cuves d'un spectrophotomètre ? - Déterminer le nombre d'oxydation du chrome dans l'ion dichromate. réponse : La solution présente une forte absorption entre 380 nm et 500 nm, dans le violet et dans le bleu. La couleur de la solution de dichromate de potassium est jaune orangée, couleur complémentaire du bleu. Pour manipuler les cuves d'un spectrophotomètre, il ne faut pas mettre les doigts sur les faces lisses : la lumière traverse ces faces. Nombre d'oxydation du chrome dans l'ion dichromate : 2 nombre d'oxydation du chrome + 7 nombre d'oxydation de l'oxyène = -2 ( charge de l'ion) Or le nombre d'oxydation de l'oxyène vaut -2 d'où : 2 nombre d'oxydation du chrome + 7 *(-2) = -2 2 nombre d'oxydation du chrome = 12 ; nombre d'oxydation du chrome = 6.
Peut causer le cancer par inhalation ; peut causer des altérations génétiques héréditaires ; nocifs pour les organismes aquatiques, peut entraîner des effets néfastes à long terme pour l'environnement. Quels sont les pictogrammes que l'on trouve sur l'étiquette d'une solution de dichromate de potassium ? Indiquer les précautions à prendre lors de la manipulation de cette solution. réponse : Port de gants, blouse, lunettes de protection et travailler sous hotte aspirante. Ne pas mettre en contact avec des substances carburantes.
Ecrire les demi équations électroniques puis l'équation de la réaction d'oxydoréduction correspondant à l'oxydation du propan-2-ol. Les couples oxydant / réducteur mis en jeu sont : Cr2O72- /Cr3+ ; C3H6 O / C3 H8 O réponse : CH3-CH(OH)-CH3 propan-2-ol 3 fois{ C3 H8 O = C3H6 O + 2 électrons + 2H+}. Cr2O72- + 6 electrons +14 H+ = 2 Cr3+ + 7 H2O 3 C3 H8 O + Cr2O72- +14 H+ donne 3 C3H6 O + 2 Cr3+ + 6 H+ + 7 H2O
|
|||
|
réponse : Masse molaire de l'alcool C3 H8 O : M= 3*12+8+16 = 60 g/mol Quantité de matière d'alcool : nA =m/M = 1,00 / 60 = = 1,67 10-2 mol Or d'aprèes les nombres stoechiométrique de l'équation ci-dessus : 1 mole d'ion dichromate réagit avec 3 moles d'alcool 1,67 10-2 /3 = 5,56 10-3mol d'ion dichromate réagit avec 1,67 10-2 mol d'alcool. n (Cr2O72- ) =[Cr2O72- ]* volume (L) volume (L) = n (Cr2O72- ) /[Cr2O72- ] volume (L) =5,56 10-3 / 1,00 10-1 = 5,56 10-2 L = 55,6 mL.
|
|||
|
|