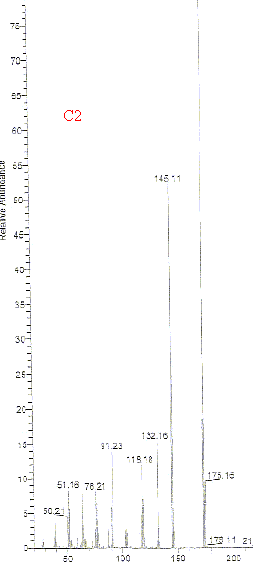|
analyse d'un explosif concours police scientifique 2005 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Trois prises d'essai d'environ 2 g de cette pâte sont analysées. Verrerie : - verre de montre utilisé pour le pesées - becher en verre de 100 mL utilisé pour la solubilisation dans le cyclohexane. - entonnoir en verre, filtre en papier - cristallisoir de 150 mL pour recueillir les filtrats. Mode opératoire : Mise en solution de chaque prise d'essai dans 20 mL de cyclohexane. Filtration sur papier filtre après avoir oté le plus gros de la partie insoluble. Remise en solution de la fraction insoluble dans 20 mL de cyclohexane puis filtration sur le filtre ayant servi lors de la précédente filtration. Effectuer plusieurs remises en solution et filtrations successives jusqu'à obtenir 100 mL de cyclohexane. Rassembler les fractions insolubles, séchage de cette fraction et du filtre et pesées à poids constant. Evaporation totale des 100 mL de cyclohexane à l'air libre et pesées à poids constant. Les pesées des prises d'essai (PE1, PE2, PE3) ainsi que les résultats des pesées des fractions insolubles et solubles sont données : Fractions insolubles :
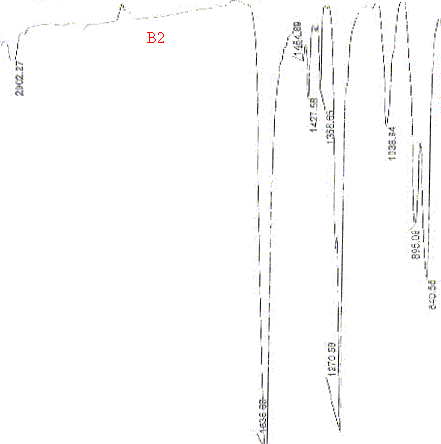
On donne les spectres d'analyse de la fraction insoluble (B1) ainsi que de composés témoins ( B2 à B5). Quelles conclusions tirez-vous de l'analyse de la fraction insoluble ? Identifier la méthode utilisée pour l'analyse de cette fraction. Quel type d'identification permet -elle ? Masse de la fraction soluble = masse échantillon + masse becher et filtre avant traitement - masse becher et filtre après traitement. Masse de la fraction insoluble = masse échantillon - masse de la fraction soluble. La fraction insoluble représente 88,6% de PE1, 88,8 % de PE2 et 88,2 % de PE3 soit en moyenne 88, 5% de la pâte. La fraction insoluble est analysée par spectrométrie infrarouge. Une molécule illuminée par des radiations dans l'infrarouge peut absorber certaines d'entre elles à des longueurs d'onde qui correspondent aux fréquences de vibration des groupements chimiques la constituant. L’infrarouge moyen (entre 1000 et 6000 cm-1) dispense suffisamment d’énergie pour stimuler les vibrations moléculaires à des niveaux d’énergie supérieurs. La mesure de l'intensité de lumière absorbée à chaque longueur d'onde l conduit à un spectre caractéristique du produit étudié. Les analyses sont le plus souvent effectuées en transmission. Le spectre obtenu représente I/I0 = f(t) avec I = intensité absorbée, I0= intensité initiale, t nombre d'onde = 1/l exprimé en cm-1. Le bromure de potassium (KBr) est
transparent aux rayonnements IR dans la zone 4000
cm-1 à 700 cm-1
Les spectres correspondants possèdent des pics identiques aux nombres d'onde suivants :. 3024 ; 2911 ; 1473 ; 1395 ; 1285 ; 1037 ; 1001 ; 849 ; 762 ; 701.
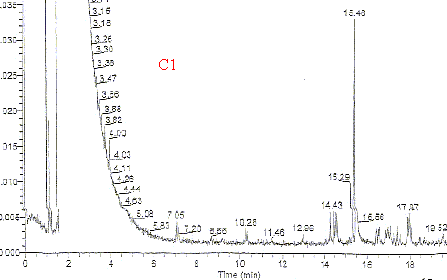
Le pic dont le temps de rétention est 15,46 min est représenté sur le document C2. Des spectres de composés témoins sont donnés C3 à C7.
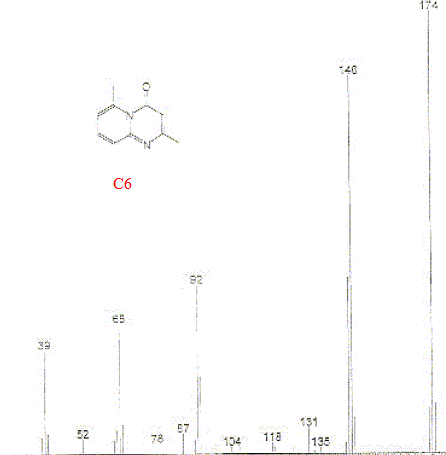
Le chromatogramme C1 met en évidence une dizaine de constituants : l'un, correspondant à tR= 15,46 min est le constituant principal. Quel est le principe de cette méthode CPG-SM ? principe général de la chromatographie : La chromatographie est une méthode de séparation et d'identification des constituants d'un mélange. La chromatographie est basée sur la différence de solubilité d'une substance dans deux phases non miscibles:la phase stationnaire liée au support et la phase mobile ou solvant. Plus une substance est soluble dans la phase mobile, plus elle est entraînée par cette phase; inversement, une substance peu soluble dans la phase mobile migre peu. Un fluide appelé phase mobile parcourt un tube appelé colonne. Cette colonne peut contenir des "granulés" poreux (colonne remplie) ou être recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les deux cas, la colonne est appelée phase stationnaire. A l'instant initial, le mélange à séparer est injecté à l'entrée de la colonne où il se dilue dans la phase mobile qui l'entraîne à travers la colonne. Si la phase stationnaire a été bien choisie, les constituants du mélange, appelés généralement les solutés, sont inégalement retenus lors de la traversée de la colonne. De ce phénomène appelé rétention il résulte que les constituants du mélange injecté se déplacent tous moins vite que la phase mobile et que leurs vitesses de déplacement sont différentes. Ils sont ainsi élués de la colonne les uns après les autres et donc séparés. Un détecteur placé à la sortie de la colonne couplé à un enregistreur permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige sur un enregistreur un signal constant appelé ligne de base en présence du fluide porteur seul ; au passage de chaque soluté séparé il conduit dans le temps à l'enregistrement d'un pic. Dans des conditions chromatographiques données, le "temps de rétention" (temps au bout duquel un composé est élué de la colonne et détecté), caractérise qualitativement une substance. L'amplitude de ces pics, ou encore l'aire limitée par ces pics et la prolongation de la ligne de base permet de mesurer la concentration de chaque soluté dans le mélange injecté. C'est en jouant sur la nature de l'éluant (et dans une moindre mesure sur la nature du support) que l'on parvient à séparer les constituants d'un mélange.
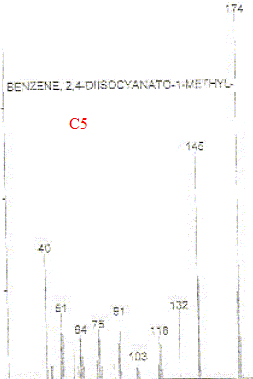
Son principe : séparation en phase gazeuse de molécules chargées d'après leur rapport masse/charge (m/z). L'impact électronique fourni de nombreux fragments et le spectre compte un très grand nombre de raies. On identifie un composé en comparant son spectre de masse à des banques de spectres de masse de composés connus. On peut identifier C2 à C5 : les spectres correspondants présentants de grandes analogies. Formule semi-développée correspondant à C3 :
Formule semi-développée correspondant à C5 :
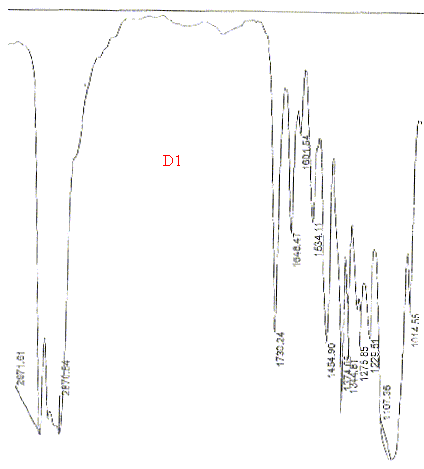
A quelle fonction correspond la bande située à 1730 cm-1 ?
Le groupe C=O donne une bande intense, de largeur moyenne, située dans la région entre 1820 et 1660 cm-1. La présence des bandes vers 2870 indique la présence du groupe OH. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||