|
Question
1 :
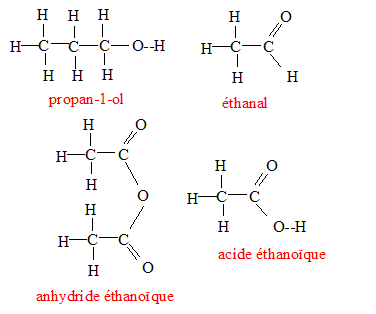
Donnez les formules développées des
molécules organiques suivantes : propan-1-ol,
éthanal, acide éthanoïque, anhydride
éthanoïque.
Question
2 :
On réalise l'oxydation ménagée de
l'éthanal en acide éthanoïque par action
d'une solution aqueuse de permanganate de potassium en
milieu acide. ( MnO4-
/Mn2+. Ecrire l'équation chimique de
la réaction d'oxydoréduction.
2 fois { MnO4-
+ 8 H++ 5e- = Mn2++
4H2O}
5 fois { CH3-CHO +
H2O = CH3-COOH + 2++
2e- }
2MnO4-
+5CH3-CHO+ 6 H+ =2
Mn2++5CH3-COOH +
3H2O
Question
3 :
On dissout 10 mmol d'acide éthanoïque dans 100
mL d'eau.
- Quelle est la concentration
molaire CS de la solution S ainsi
obtenue.
- Ecrire l'équation de la
réaction entre l'acide éthanoïque et
l'eau. Donner l'expression de sa constante
d'équilibre Ka.
- Le pH de la solution est
égal à 2,9.
- Calculer la concentration molaire
[H3O+].
- Calculer le taux d'avancement t
de cette réaction et
sa constante d'équilibre
Ka.
CS =
quantité de matière (mmol ) / volume (mL) = 10
/ 100 = 0,10
mol/L.
CH3-COOH +
H2O = CH3-COO- +
H3O+ ; Ka =
[CH3-COO-]éq[H3O+]éq/[CH3-COOH]éq.
[H3O+]
= 10-pH = 10-2,9 =
1,26 10-3
mol/L.
t
= xmax /
xfin avec xmax = 0,01 mol ;
xfin =[H3O+] *V =
1,26 10-3*0,1 = 1,26 10-4
mol.
t
= 1,26
10-2.
Calcul de Ka :
solution électriquement neutre :
[H3O+]
=[CH3-COO-]
conservation de
l'élément carbone :
[CH3-COO-]
+[CH3-COOH] = 0,1 d'où
[CH3-COOH] = 0,0987.
Ka =(1,26
10-3)2/0,0987
=1,6
10-5.
Question
4 :
On dispose des produits organiques donnés dans la
partie 1 : proposer une réaction chimique permettant
d'obtenir l'éthanoate de propyle.
- Ecrire l'équation chimique choisie et donner ses
caractéristiques.
CH3-COOH +
CH3-CH2-CH2OH
=
CH3-COO-CH2-CH2-CH3
+ H2O
lente, limitée par
l'hydrolyse de l'ester, athermique.
(CH3-CO)2O
+
CH3-CH2-CH2OH
-->
CH3-COO-CH2-CH2-CH3
+ CH3-COOH
rapide, totale, exothermique.
Question
5 :
On met 1,0 10-2 mol d'éthanoate de propyle
et 1,0 10-2 mol d'hydroxyde de sodium dans un
volume V=1,0 L d'eau.
- Ecrire l'équation
chimique de la réaction de
saponification.
- On mesure à intervalles
de temps réguliers la concentration C en
éthanoate de propyle restant :
|
t(min)
|
0
|
10
|
20
|
30
|
40
|
50
|
|
c(mol L-1)
|
|
7,7 10-3
|
6,2 10-3
|
5,3 10-3
|
4,5 10-3
|
4,010-3
|
|
1/C L mol-1
|
|
|
|
|
|
|
- Tracer 1/C en fonction de t.
- Donner littéralement l'équation de la
droite ; noter K son coefficient directeur. En
déduire l'expression littérale de C en
fonction de K, C0 et t ( C0
concentration initiale de l'ester).
- Montrer que la vitesse volumique de la réaction
est de la forme KCa.
Déterminer a.
- Calculer le temps de demi-réaction
t½.
- Calculer la vitesse volumique de la réaction
à t =0 et à
t=t½.
Equation chimique de la
réaction de
saponification :
CH3-COO-CH2-CH2-CH3
+Na+ + HO- = CH3-COO-
+ Na+
+CH3-CH2-CH2OH
|
t(min)
|
0
|
10
|
20
|
30
|
40
|
50
|
|
c(mol L-1)
|
0,01
|
7,7 10-3
|
6,2 10-3
|
5,3 10-3
|
4,5 10-3
|
4,010-3
|
|
1/C L mol-1
|
100
|
130
|
161
|
189
|
222
|
250
|
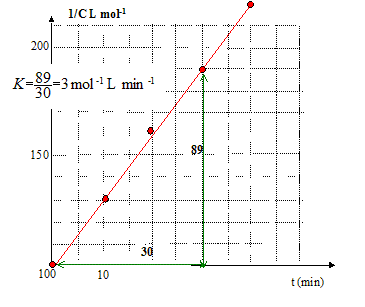
Equation de la droite :
1/C = Kt +
1/C0
(1)
expression littérale de C :
(C0-C) / (CC0) = Kt ; C0-C
= CC0Kt ; C=
C0/(1+C0Kt).
vitesse volumique de la
réaction : v = -dC/dt
différentier
(1)
: -dC/C2 = Kdt ; -dC/dt =
KC2.
a
= 2.
temps de
demi-réaction t½ :
à t½, la
concentration C est égale à
½C0 d'où d'après (1)
:
1/C0=Kt½
; t½ =1/(C0K) =1/(0,01*3) =
33
min.
vitesse volumique de la
réaction :
v(t=0 ) =KC02
= 3*0,012 = 3
10-4 mol L-1
min-1.
v(t=t½ )
=K(½C0)2 =
7,5 10-5 mol
L-1
min-1.
|

