|
Concours kiné
Limoges
: électrolyse
solution chlorure de fer III ; spectrophotométrie
2007
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
Electrolyse d'une solution de chlorure de fer III (2,5 pts) En faisant l'électrolyse d'une solution aqueuse de 100 mL de chlorure de fer III ( Fe3+ + 3Cl-) dont la concentration en produit apporté est de 5,0 10-2 mol/L, on observe un dépôt métallique sur l'une des électrodes. L'intensité du courant vaut I= 1,0 A, valeur constante durant les 10 minutes de l'électrolyse. F = 1,0 105 C mol-1 ; M(Fe) = 56 g/mol.
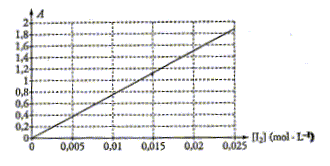
On dispose de la courbe d'étalonnage d'un spectrophotomètre. Celle -ci représente pour une longueur d'onde choisie la variation de l'absorbance A d'une solution de diiode en fonction de sa concentration molaire volumique[I2].
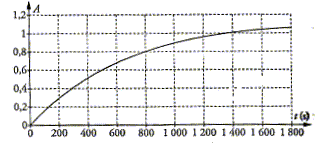
On étudie par spectrophotométrie la réaction suivante : 2I-(aq) + S2O82-(aq) = I2(aq)+2SO42-(aq) Soit n0 la quantité initiale d'ions I-(aq) ; l'ion peroxodisulfate S2O82-(aq) reste toujours en excès. Pour la même longueur d'onde que celle utilisée pour l'étalonnage, la courbe représentant en fonction du temps les variations de l'absorbance d'une cuve contenant le milieu réactionnel est la suivante :
En faisant l'électrolyse d'une solution aqueuse de 100 mL de chlorure de fer III ( Fe3+ + 3Cl-) dont la concentration en produit apporté est de 5,0 10-2 mol/L, on observe un dépôt métallique sur l'une des électrodes. L'intensité du courant vaut I= 1,0 A, valeur constante durant les 10 minutes de l'électrolyse. Le dépôt de fer ( réduction de Fe3+) a lieu sur la cathode reliée à la borne négative du générateur. Fe3+ + 3e- = Fe(s). Masse de fer déposée à la fin de l'électrolyse : Quantité d'électricité ( C) = intensité (A) * durée (s) ; Q= It = 1*10*60 = 600 C Quantité de matière d'électrons : Q/105 = 600 / 105 = 6 10-3 mol. Quantité de matière de fer : n(Fe) = 1/3 n(e-) = 2 10-3 mol. masse (g) = quantité de matière (mol) * masse molaire (g/mol) m= nM= 2 10-3 *56 = 0,112 g ( 0,11 g). Avancement maximal de la réaction : xmax = n(Fe3+)initial = [Fe3+]initial * V = 5,0 10-2*0,1 = 5 10-3 mol. Taux d'avancement final au bout de 10 minutes d'électrolyse : t=
xf/xmax =2
10-3 / 5 10-3 =
0,4.
Etude d'une réaction par spectrophotométrie : Tableau d'avancement de la réaction :
Coefficient directeur de la droite : 1,85 / 0,025 = 74 L mol-1. A= 0,74 [I2]. Au bout d'un temps suffisamment long l'absorbance du
milieu réactionnel ne varie plus et vaut
Af=1,1. Or [I2]f =xmax/V = n0/(2V) ; [I-]0 = n0/V d'où [I-]0 =2 [I2]f =2*0,015 ; [I-]0 = 0,030 mol/L. Concentration en ion iodure pout t= 800 s : A800 = 0,8 ( lecture graphe) [I2]800 = A800/74 = 0,8/74 = 0,011 mol/L. ( 0,0108) n(I-)= n0 -n800 = n0 -2x avec x = 0,0108 V [I-]800 =(n0 -2x)/V = [I-]0 - 2x=0,030-2*0,0108 ; [I-]800 = 8,4 10-3 mol/L. |
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|