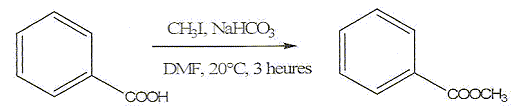|
La ciprofloxacine : hydrolyse d'un ester ; benzoate de méthyle concours technicien chimiste Lille 2007 |
|||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
|
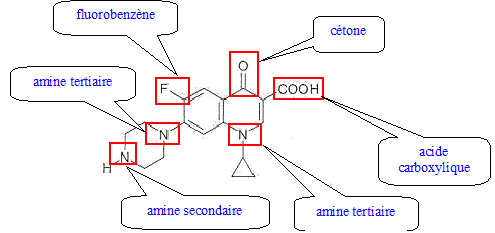
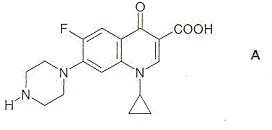
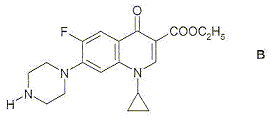
B est un ester ; A est l'acide carboxylique correspondant. B + eau = A + C2H5OH ( éthanol ) - réaction d'hydrolyse de l'ester équilibrée par la réaction inverse, l'estérification. En éliminant l'un des produits au fur et à mesure qu'il se forme, l'équilibre est déplacé vers la droite ( sens direct) : la réaction est alors totale. En utilisant un excès d'eau, on déplace également l'équilibre vers la droite. - hydrolyse basique de l'ester A : la réaction est totale. B + Na+ + HO- --> ion carboxylate issu de A + Na+ + C2H5OH ( éthanol )
Masse molaire ( g/mol) : H : 1,0 ; C = 12,0 ; O : 16,0 ; Na : 23,0 ; I : 126,9. Densité ( masse volumique) de CH3I à 20 °C : 2,28.
M( acide benzoïque C7H6O2 ) = 7*12+6+2*16 = 122,0 g/mol n = masse(g) / masse molaire (g/mol) = m/M ; n = 10,0 / 122,0 =8,20 10-2 mol ( valeur plus précise pour la suite des calculs : 8,196 10-2) M(CH3I) = 12+3+126,9 = 141,9 g/mol 2n = 2* 8,196 10-2 =0,164 mol masse (g) = quantité de matière (mol) * masse molaire (g/mol) = n M = 0,164* 141,9 = 23,3 g. ( 23,27) volume (mL) = masse (g) /
densité = 23,27 / 2,28 =
10,2
mL.
1,2n = 1,2* 8,196 10-2 =9,84 10-2 mol masse (g) = quantité de
matière (mol) * masse molaire (g/mol) = n M =
9,84 10-2 * 84,0 =
8,26
g.
M( ester C8H9O2 ) = 8*12+9+2*16 = 137,0 g/mol A partir de n mol d'acide benzoïque on peut obtenir au mieux n mole d'ester, d'après les coefficients stoechiométriques. n(ester) théorique = 8,196 10-2 mol masse théorique d'ester = 8,196 10-2 *137,0 = 11,2 g ( 11,228 ) rendement : 10,5/11,228 =0,9357 ( 93,5 %)
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|