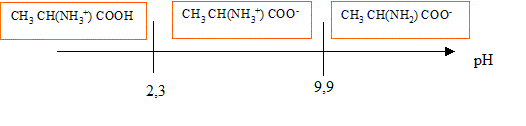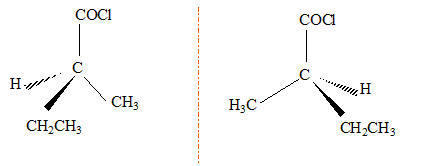|
Technicien de recherche ( Lille 2000) électrolyse ; pile ; oxydoréduction, acide base, chlorure d'acyle |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
absence de flammes ; port de gants, blouse et lunettes ; travail sous hotte |
|||||||||||||||||||||||||||||||||||
|
La bauxite est le minerai d'aluminium. Sachant que l'aluminium est situé dans la classification périodique des éléments dans la même colonne que le bore B (Z=5) dans la période suivante :
corrigé numéro atomique de l'aluminium : Z= 5 + 8 = 13 même colonne ( même famille) que le bore : donc 3 électrons externes ; période suivante : donc 8 électrons de plus que le bore. La formule de l'alumine : Al2O3 ( 2 Al3+ + 3O2-) Equations des réactions qui ont lieu à chaque électrode : à l'anode positive, oxydation : 3O2- = 1,5 O2 + 6e-. à la cathode négative, réduction : 2 Al3+ + 6e- = 2Al Bilan : 2 Al3+ +
3O2- = 1,5 O2 + 2Al ou
Al2O3=1,5 O2 + 2Al
n= 106/27 = 3,70 104 mol D'après les coefficients stoechiométriques de l'équation bilan : n(Al2O3) = ½ n(Al) n(Al2O3) = 1,85 104 mol Masse molaire de l'alumine : M= 2*27+3*16 = 102 g/mol masse d'alumine (g) = masse molaire (g/mol) * quantité de matière (mol) m = 102*1,85 104 =1,89 106 g = 1,89 t masse de minerai : 1,89/0,75
= 2,52
t.
Al3+ + 3e- = Al donc quantité de matière d'élctrons n(e-) = 3 n(Al )= 3* 3,70 104 = 1,11 105mol Quantité d'électricité Q=n(e-) F = 1,11 105 *9,65 104 = 1,07 1010 C Or Q= I t soit t = Q/I = 1,07 1010/ 2,5 105 = 4,28 104 s = 714 min = 11,9 heures. Vitesse moyenne de formation de l'aluminium en mol/min : n(Al) / t = 3,70 104 /714 = 51,8 mol/min.
|
|||||||||||||||||||||||||||||||||||
|
On réalise la pile à 298 K : électrodes de platine plongeant dans les solutions suivantes : première demi-pile : Fe2+(aq) 5 10-3 mol/L ; Fe3+(aq) 2 10-2 mol/L seconde demi-pile : AsO43- (aq) 0,2 mol/L ; AsO33- (aq) 0,1 mol/L, tampon à pH=2. On donne : E°(Fe3+/Fe2+) = 0,77 V ; E°(AsO43-/AsO33-) = 0,56 V ;
corrigé Equations des réactions qui ont lieu dans chacun des compartiments : anode négative, oxydation : AsO33- + H2O= AsO43- + 2H+ + 2e-. cathode positive, réduction : 2Fe3+ + 2e- =2 Fe2+. Sens conventionnel du courant soit le sens contraire du déplacement des électrons : dans le cirduit extérieur,
le courant part du platine plongeant dans la solution
contenant (Fe3+/Fe2+).
E1 = E°(AsO43-/AsO33-) + 0,06/2 log ([AsO43- ][H+]2/[AsO33-]) (1) E1 =0,56 + 0,03 log(0,2 * 10-4 / 0,1) =0,45 V. E2 =E°(Fe3+/Fe2+) + 0,06/1 log ([Fe3+]/[Fe2+]) (2) E2 =0,77 + 0,06 log(2 10-2/5 10-3) = 0,81 V. f.e.m initiale = E = E2
-E1 =0,81-0,45 = 0,36 V.
2Fe3+ + AsO33- + H2O= AsO43- + 2H+ +2 Fe2+. Constante d'équilibre relative à cette réaction : K= [Fe2+]2[H+]2[AsO43- ] / ([Fe3+]2[AsO33-]) à l'équilibre E1 = E2 ; E°(AsO43-/AsO33-) + 0,06/2 log ([AsO43- ][H+]2/[AsO33-]) = E°(Fe3+/Fe2+) + 0,06/2 log ([Fe3+]2/[Fe2+]2) 0,06/2 log ([AsO43- ][H+]2/[AsO33-]) - 0,06/2 log ([Fe3+]2/[Fe2+]2) = E°(Fe3+/Fe2+) - E°(AsO43-/AsO33-) 0,03 log ([Fe2+]2[H+]2[AsO43- ] / ([Fe3+]2[AsO33-]) = 0,77-0,56 = 0,21 0,03 log K = 0,21 ; log K =
0,21/0,03 = 7 ; K=
107.
|
|||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||
|
Un alliage de laiton ( Cu+ Zn) est soumis à l'action d'un acide dilué. On fait réagir l'acide chlorhydrique en excès sur 40 g de laiton. Le gaz qui se dégage occupe un volume de 5,6 L mesuré dans les CNTP.
corrigé Seul le zinc est attaqué par l'acide chlorhydrique Zn(s) + 2H+(aq) = Zn2+(aq) + H2(g) Quantité de matière de dihydrogène (mol) = volume (L) / volume molaire ( L/mol) n(H2) = 5,6 / 22,4 = 0,25 mol d'après les nombres stoechiométriques de l'équation n(Zn) = n(H2) = 0,25 mol masse de zinc (g) = quantité de matière (mol) * masse molaire (g/mol) m = 0,25*65,4 =16,3 g masse de cuivre : 40-16,3
=23,7
g.
|
|||||||||||||||||||||||||||||||||||
|
Sans pollution l'acidité des nuages est celle d'une solution aqueuse en équilibre avec les gaz atmosphériques, en particulier CO2. Seuls les équilibres suivants seront considérés : (1) CO2(g) = CO2(aq) ; K1= [CO2(aq)]/PCO2=2,3 10-7. (2) CO2(aq) + H2O = H2CO3 ; K2=3,4 10-3. (3) H2CO3 + H2O = HCO3-+H3O+ ; K3=1,32 10-4. (4) HCO3-+ H2O = CO32-+H3O+ ; K4=5,6 10-11. avec PCO2 pression partielle ( en Pa) de CO2 dans l'air. L'air contient 0,03 % de CO2 en volume. Tous les gaz sont considérés comme parfait et la pression atmosphérique est P= 105 Pa. Estimer le pH de l'eau du nuage. corrigé (1) + (2) + (3)+(4) donne : CO2(g)+3 H2O = CO32- +2 H3O+ avec K = K1K2 K3K4 K =2,3 10-7 *3,4 10-3*1,32 10-4*5,6 10-11 = 5,78 10-24. de plus K = [CO32-][H3O+]2/ PCO2 avec PCO2 = 3 10-4 P = 3 10-4*105 = 30 Pa.
[H3O+] = 2xéq =7 10-8 ; pH = -log(7 10-8) = 7,15.
|
|||||||||||||||||||||||||||||||||||
|
On fait réagir, à température ambiante, en milieu acide une masse connue d'herbicide en présence d'une quantité connue et en excès d'ion bromure. Une partie de ces ions est oxydée en dibrome tandis que les ions chlorates sont réduits en ions chlorure.
corrigé ClO3- / Cl- : ClO3- +6H++6e-= Cl- +3H2O Br2/Br- : 6Br- = 3 Br2 + 6e-. Bilan :
ClO3- +6H++6Br-
= 3 Br2 +Cl- +3H2O
(1)
Br2/Br- : Br2 + 2e- = 2Br-. I2/I- : 2I- = I2 + 2e-. Bilan : Br2
+2I- = I2 +2Br-
(2)
I2/I- : I2 + 2e-=2I-. S4O62-/S2O32- : 2S2O32- = S4O62-+ 2e-. Bilan :
2S2O32- +I2 =
S4O62- +2I-
(3)
(3) donne : n(I2 ) = ½n(S2O32-) = ½[S2O32-] VE (2) donne : n(I2 ) = n(Br2 ) =½[S2O32-] VE (1) donne : n(ClO3-) =1/3n(Br2 ) =1/6 [S2O32-] VE [ClO3-] =n(ClO3-) / V0 = 1/6 [S2O32-] VE/ V0 . [ClO3-] = 0,1*13/60 = 2,17 10-2 mol/L. Concentration en g/L de la solution à doser : M(NaClO3)= 23 +35,5+64 =122,5 g/mol 122,5*2,17 10-2 = 2,65 g/L. Pourcentage de chlorate de sodium dans l'échantillon : 2,65/3*100 = 88,5 %.
|
|||||||||||||||||||||||||||||||||||
|
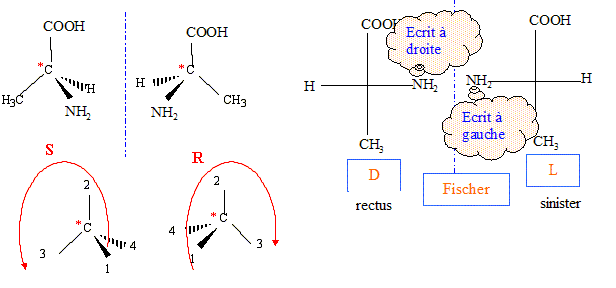
La L-alanine est l'un des acides aminés naturels présents dans les protéines, sa formule est : HOOC- CH( NH2) CH3.
corrigé énantiomères :
Equation des deux couples acido-basiques de l'alanine : HOOC-RCH-NH3+ + H2O =
-OOC-RCH-NH3+ +
H3O+ pKa1= 2,3 les espèces prédominantes en fonction du pH :
Lorsqu'on dissout de l'alanine dans l'eau, elle est essentiellement sous forme d'ion dipolaire -OOC-RCH-NH3+,( du fait de la forte solubilité dans l'eau) la concentration en molécules HOOC-RCH-NH2 est négligeable. Expression de son pH dans ces conditions : On note AH+ : HOOC-RCH-NH3+ ; A : -OOC-RCH-NH3+ ; A- : -OOC-RCH-NH2 et [H3O+] : h AH+ + H2O = A+ H3O+ ; Ka1 = [A] h / [AH+] A + H2O = A- + H3O+ ; Ka2 = [A-]h / [A] conservation A : [AH+]+[A]+[A-]=C ; or A majoritaire dans l'eau : [A] voisin C mol/L solution électriquement neutre : h+ [AH+] = [OH-]+[A-] hypothèse : h et [OH-] négligeable devant [AH+] et [A-] alors [AH+] =[A-] Ka1 * Ka2 = h²[A-] / [AH+] h²= Ka1 * Ka2 ; 2 log h = log Ka1 + log Ka2 ; pH = ½(pKa1 + pKa2). On prépare 100 mL d'une solution A de chlorhydrate d'alanine symbolisée ( AlH+, Cl-) de concentration c=0,5 mol/L. Le pH de cette solution étant 1,3, calculer pKa1. à pH 1,3 les eules espèces à prendre en compte sont AH+ et A avec : AH+ + H2O = A + H3O+ et Ka1 =[A][H3O+]/[AH+] or [A]= [H3O+] et [AH+] + [A]= c d'où : Ka1 =[H3O+]2 / (c-[H3O+]) avec [H3O+] = 10-pH= 10-1,3 = 5 10-2. Ka1 =0,052/(0,5-0,05) = 5,55 10-3 ; pKa1 = -log(5,55 10-3) = 2,3. Une solution d'alanine dans l'eau, obtenue lors de la neutralisation, a un pH de 6,1. Calculer pKa2. pH = ½(pKa1 + pKa2) ; pKa2 = 2pH-pKa1 = 12,2-2,3 = 9,9.
|
|||||||||||||||||||||||||||||||||||
|
Un chlorure d'acyle A avec une chaîne carbonée non cyclique contient 13,3 % en masse d'oxygène.
corrigé formule brute : CxHyOCl ; masse molaire M= 12 x+y+16+35,5 = 12x+y+51,5 16/ 13,3 = M/100 d'où M= 120,3 g/mol d'où 12x+y = 120,3-51,5 = 69 soit C5H9 OCl. isomères de chaîne : CH3-(CH2)3COCl : chlorure de pentanoyle. (CH3)2CH-CH2-COCl : chlorure de 3-méthylbutanoyle CH3-CH2-CH [CH3 ]-COCl : chlorure de 2-méthylbutanoyle CH3-C[CH3 ]2-COCl : chlorure de 2,2-diméthylpropanoyle A possède un carbone asymétrique : CH3-CH2-CH [CH3 ]-COCl : chlorure de 2-méthylbutanoyle
alcool B : formule CnH2n+2O ; M= 14n+2+16 = 14 n+18 (2n+2) / 13,3 = M/100 = (14n+18) / 100 ; 2n+2 = 1,862 n +2,394 ; n voisin de 3 soit C3H7OH. CH3-CH2-CH2OH propan-1-ol ; CH3-CH(OH)-CH3 propan-2-ol. Le test positif à la liqueur de Fehling met en évidence un aldehyde : en conséquence B est un alcool primaire, le propan-1-ol. structure de C : CH3-CH2-CH [CH3 ]-COO-CH2-CH2-CH3 estérification entre A et B : CH3-CH2-CH [CH3 ]-COCl + CH3-CH2-CH2OH--->CH3-CH2-CH [CH3 ]-COO-CH2-CH2-CH3 +HCl.
|
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
|