|
pile au lithium, solubilité oxalate de calcium, mélange phénol nitrobenzène et absorbance concours ITRF 2001 Lille |
|||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||
|
Couples oxydant / réducteur : Li+ / Li E°=-3,02 V ; I2/I- E°= 0,53 V. L'électrolyte utilisé est anhydre et la capacité utile de la pile est 1,8 Ah. L'intensité du courant est I= 100 mA et la masse de la pile est m = 23 g.
2Li =2 Li+ +2 e-. oxydation Le diiode se réduit à la cathode positive suivant : I2 + 2e- = 2I-. Bilan : 2Li +I2=2 Li+ + 2I-. Le courant circule dans le circuit extérieur en sens contraire des électrons : donc de la borne positive vers le lithium. La f.e.m de la pile vaut : 0,53-(-3,02) = 3,55 V. L'électrolyte doit être anhydre car le lithium réagit violemment avec l'eau. Autonomie de la pile : Q=It avec Q= 1,8 Ah, I= 10-4 A et t en heures. t = Q/I = 1,8 / 10-4 = 1,8 104 heures = 2,0 années. Masse de lithium et de diiode sont enfermés dans la pile pour obtenir cette autonomie : Quantité de matière d'électrons (mol) = Q ( coulomb) / 96500 = 1,8 *3600 / 96500 = 6,72 10-2 mol. Li = Li+ + e-. Donc n(Li) = n(e- ) = 6,72 10-2 mol. masse de lithium (g) = quantité de matière (mol) * masse molaire du lithium ( g/mol) = 6,72 10-2 *6,9 = 0,46 g. I2 + 2e- = 2I-. Donc n(I2) = 0,5 n(e- ) = 3,36 10-2 mol. masse de diiode (g) = quantité de matière (mol) * masse molaire du diiode ( g/mol) = 3,36 10-2 *(2*126,9) = 8,52 g. Vitesse de disparition du lithium en mol h-1 : 6,72 10-2 /1,8 104 =3,7 10-6 mol h-1.
Le produit de solubilité à 37 °C de l'oxalate de calcium est Ks= 3,6 10-9 en exprimant les concentrations en mol/L. Quel serait le volume d'eau pure nécessaire pour dissoudre ce calcul ? Masse molaire Ca(CO2)2 : M= 40 + 2*(12+32) = 128 g/mol. Quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 0,768 / 128 = 6 10-3 mol. Ca(CO2)2 = Ca2+ + 2CO2-. Ks = [ Ca2+][CO2-]2 ; on pose s = [ Ca2+] ; [CO2-] = 2 [ Ca2+] = 2s. Ks = s (2s)2 = 4 s3. s3 = 0,25 Ks =0,25*3,6 10-9 = 9 10-10. s = 9,6 10-4 mol /L. Volume d'eau pure : 6
10-3 / 9,6 10-4 =
6,2
L.
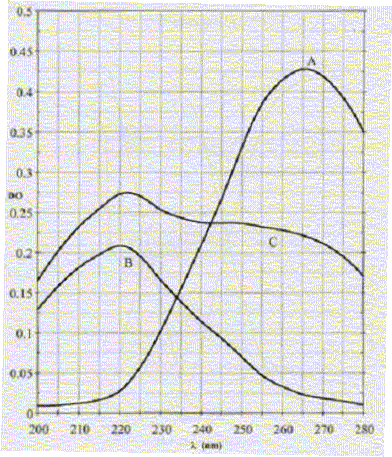
A : C6H5-OH : 188 mg dans 500 mL. B : C6H5-NO2 : 154 mg dans 500 mL. Les spectres sont représentés ci-dessous :
La solution C est un mélange inconnu de phénol et de nitrobenzène.
Masse molaire du phénol : M= 6*12+6+16 = 94 g/mol n= m/M = 0,188 / 94 = 2 10-3 mol. [phénol] =n/V =2 10-3/0,5 = 4 10-3 mol/L. Masse molaire du nitrobenzène : M= 6*12+5+14+32 = 123 g/mol n= m/M = 0,154 / 123 = 1,25 10-3 mol. [nitrobenzène] =n/V =1,25 10-3/0,5 = 2,5 10-3 mol/L. Coefficients d'extinction molaire du phénol et du nitrobenzène à l= 220 nm et 265 nm pour une cuve de 1 cm. A = e
c L avec c en mol
L-1, L en cm et e
en L mol-1 cm-1. A 220 nm, écrire que les densités optiques ou absorbances s'ajoutent : 0,275 = 6,25 c1 + 84 c2 (1). avec c1, concentration du phénol , c2 concentration du nitrobenzène dans C. A 265 nm, écrire que les densité optique ou absorbance s'ajoutent : 0,225 = 106,25 c1 + 10 c2 (2). Multiplier par 8,4 1,89 = 892,5 c1 + 84 c2 (2'). (2')-(1) donne : 1,665 = 886,25 c1 ; c1 = 1,88 10-3 mol/L. c2 = (0,275-6,25*1,88 10-3) / 84 = 3,13 10-3 mol/L. |
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||