|
Dosage conductimétrique des ions chlorure dans une lotion capillaire concours assistant d'ingénieur 2007 chimiste |
|||||||||||||||||
|
|||||||||||||||||
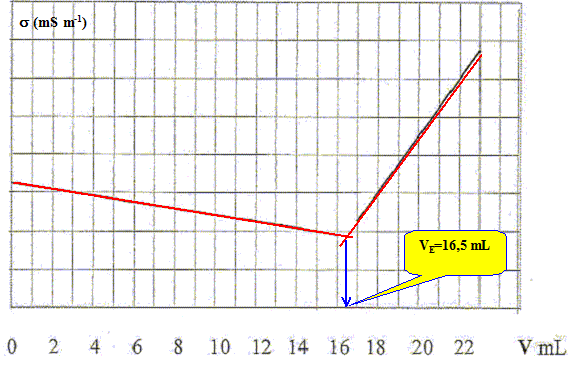
Faire un bilan des espèces présentes avant l'équivalence. En déduire l'expression de la conductivité de la solution en fonction des conductivités molaires ioniques et des concentrations des espèces chimiques présentes. réponse : L'ion argent est en défaut ; l'ion chlorure est en excès ; les ions nitrate et sodium sont spectateurs. ( les ions oxonium et hydroxyde sont minoritaires) s = lNa+[Na+] + lCl-[Cl-] + lNO3-[NO3-] Faire un bilan des espèces présentes après l'équivalence. En déduire l'expression de la conductivité de la solution en fonction des conductivités molaires ioniques et des concentrations des espèces chimiques présentes. réponse : L'ion chlorure est en défaut ; l'ion argent est en excès ; les ions nitrate et sodium sont spectateurs. ( les ions oxonium et hydroxyde sont minoritaires) s = lNa+[Na+] + lAg+[Ag+] + lNO3-[NO3-] Le suivi conductimétrique du dosage de 10,0 mL de la phase aqueuse, à laquelle on a ajouté 200 mL d'eau distillée, par une solution de nitrate d'argent de concentration c0= 0,01 mol/L.
- Proposer une explication du changement de pente à l'équivalence. réponse : Avant l'équivalence : on ajoute x = c0 V mol d'ion argent ( qui demeure en défaut ) et x = c0 V mol d'ion nitrate. x mol d'ion chlorure disparaissent : du point de vue de la conductivité, tout se passe comme si on remplaçait l'ion chlorure par l'ion nitrate. Or lCl- > lNO3- donc la conductivité de la solution diminue. Après l'équivalence : on ajoute x = c0 V mol d'ion argent ( qui est en excès de c0(V-VE) ) et x = c0 V mol d'ion nitrate. L'ajout d'ions en solution se traduit par une augmentation de la conductivité de la solution.
|
|||||||||||||||||
|
réponse : A l'équivalence : c V = c0VE soit c = c0VE / V = 0,01 *16,5 / 10 =1,65 10-2 mol/L. - Quelle aurait été l'allure des courbes si l'on avait pas dilué la solution ? réponse : Avant l'équivalence : s = lNa+[Na+] + lCl-[Cl-] + lNO3-[NO3-] on ajoute x = c0 V mol d'ion argent ( qui demeure en défaut ) et x = c0 V mol d'ion nitrate à 10 mL de prise d'essai ; x mol d'ion chlorure disparaissent : [Na+] =10 c / (V+10) ; [Cl-] =(10 c -c0 V)/ (V+10) ; [NO3-] =c0 V/ (V+10) s = [lNa+10 c + lCl-(10 c -c0 V)+ lNO3-c0 V]/ (V+10) s = [(lNa+ + lCl-) 10 c + ( lNO3- -lCl-)c0 V)]/ (V+10) de la forme : s = (A-B V) / (V+10) avec A et B constantes positives. La courbe est une portion de branche d'hyperbole.
|
|||||||||||||||||
|
|