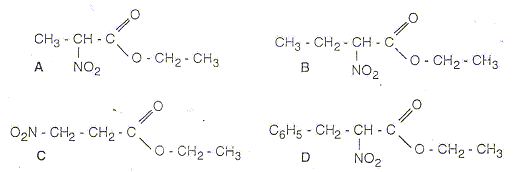|
Concours assistant d'ingénieur chimiste 2000 ( Montpellier) |
|||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
|
Chimie organique :
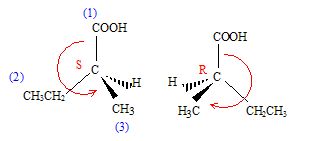
formule brute : C5H10O2. noms : 1 : acide pentanoïque ; 2 : acide 2-méthylbutanoïque ; 3 : acide 3-méthylbutanoïque ; 4 : acide 2,2-diméthylpropanoïque. 2 possède un carbone asymétrique , carbone tétraédrique lié à 4 substituants différents.
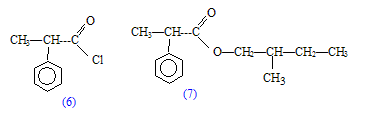
Le composé 2 subit une réduction avec LiAlH4 pour conduire à 5 , un alcool primaire, le 2-méthylbutan-1-ol.
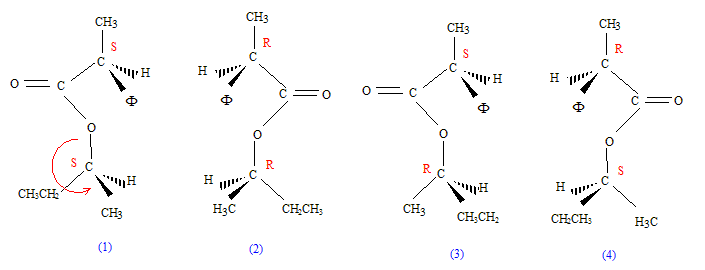
(7) possède deux carbones asymétriques, donc 4 isomères :
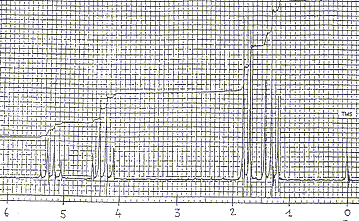
1 et 2 : énantiomères ; 3 et 4 énantiomères ; 1 et 3 diastéréoisomères ; 2 et 4 diastéréoisomères ; RMN : Le spectre RMN ci-dessous a été enregistré dans les conditions suivantes : 60 MHz, solvant : tétrachlorure de carbone ; référence TMS Ce spectre correspond à une des molécules parmi les 4 représentées ci-dessous :
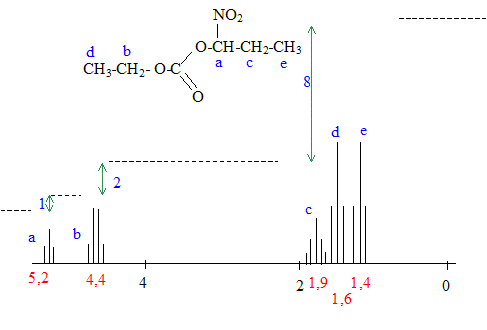
Le spectre ne comporte pas de signal ayant un déplacement chimique entre 6 et 8 : donc pas de protons benzéniques et D est exclu. La courbe d'intégration indique 11 protons : A, B et D sont exclus.
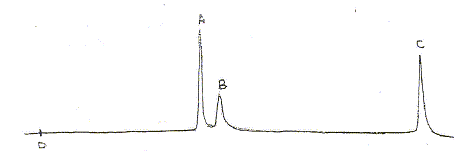
Une solution standard comprenant
trois composés A, B et C, tous trois à la
concentration c= 10 mg/L est analysée par
chromatographie liquide haute performance ( CLHP) dans les
conditions suivantes : colonne garnie de silice
greffée C18, phase mobile
eau/méthanol, débit : 0,9 mL/min, injection
par vanne avec boule de 20 mL,
détection dans l'UV à 254 nm. Le
chromatogramme obtenu est donné ci-dessous
:
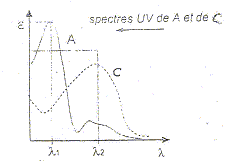
Le "temps de rétention" :(temps au bout duquel un composé est élué de la colonne et détecté), caractéristique d'un composé pour une colonne et un éluant donnés. Classification des trois composés en fonction de leur polarité : La colonne apolaire retient le composé le moins polaire A qui sort donc en dernier ; le plus polaire C sort en premier. La résolution entre les pics A et B n'est pas très bonne ; entre B et C elle est bonne. Pour améliorer cette chromatographie on peut utiliser une phase mobile de polarité différente. Une prise d'essai de 100 mL d'un échantillon d'eau est extraite par un solvant organique. L'extrait est concentré à 10,0 mL. Cet extrait concentré est injecté dans les mêmes conditions opératoires. Le chromatogramme ne montre qu'un seul pic de temps de rétention 7,86 min : on identifie donc A. La surface du pic est
proportionnelle à la concentration du composé
: c =10*5817/6473=9 mg/L
Question 4 : Un composé de masse molaire M=132 est en solution dans un solvant non absorbant à la concentration 30 mg/L. L'absorbance de cette solution est A=0,360 en cuve de 20 mm.
A= log (I0/I) = elc ( A est l'absorbance ou densité optique) où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). c=0,03/132=2,27 10-4 mol/L ; longueur 2 cm ; A= 0,36 ; e =A/(lc)=0,36/(2*2,27 10-4 )=793 L mol-1 cm-1 Absorbance d'une dilution au 1/3 de cette solution, mesurée à la même longueur d'onde en cuve de 10 mm : la longueur de la cuve est divisée par deux : A est divisée par 2 ; De plus, la concentration est divisée par 3 : A est divisée par 3 : au total l'absorbance est divisée par 6 soit A=0,36/6 = 0,06.
Solution tampon : présence d'un couple acide base faible CH3COOH / CH3-COO- tel que la concentration de la forme acide est égale à la concentration de la base conjuguée. Le pH de la solution est
égal au pKa du couple acide base soit
pH=4,7. Le pH diminue de 0,09. |
|||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|