|
concours Geipi
saponification d'un
ester et conductimétrie
2007
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
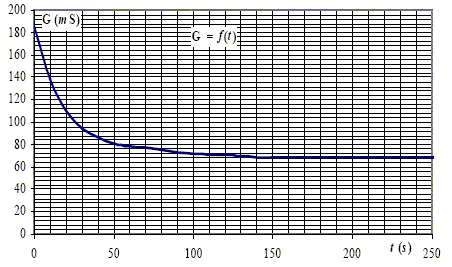
On rappelle que G est proportionnelle à la conductivité de la solution : G = k.s.
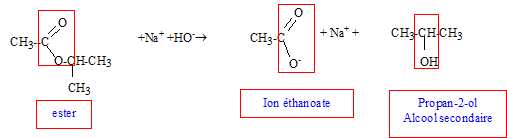
Nom de l'ester E en nomenclature officielle : CH3COOCH(CH3)CH3 : éthanoate de 1-méthyléthyle. Equation de la réaction chimique de saponification :
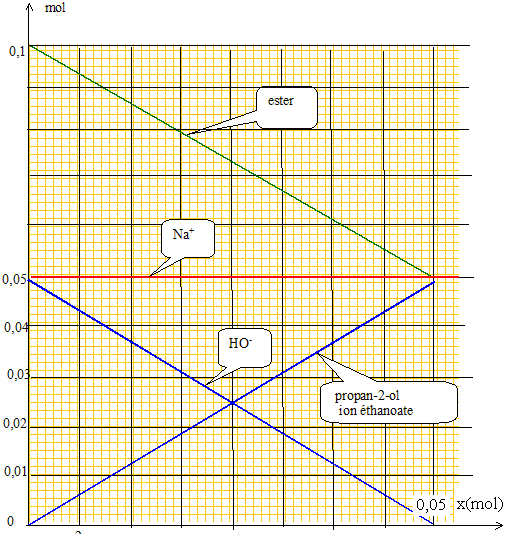
On désire opérer en présence d'un excès de E : masse minimale mmin de E : n(ester) = n0 = 5,0.10-2 mol. masse molaire de l'ester M= 5*12+10+32=102 g/mol masse (g) = masse molaire (g/mol) * quantité de matière (mol) mmin= M n(ester) = 102*5 10-2 ; mmin= 5,1 g. On réalise l'expérience avec 0,1 mol de l'ester E. Sachant que la réaction peut être considérée comme totale, porter graphiquement l'évolution de la quantité de chaque espèce en solution en fonction de l'avancement x. Echelle : 1 unité = 10-2 mol.
La conductivité s est reliée aux concentrations des différents ions (exprimées en mol.m-3) par leur conductivité molaire ionique l. unité de l : S m2 mol-1. Expression de G(t) : G0= k s0= k( lNa+ +lHO-)n0/V G(t) = k s=k [ lNa+ n0 +lHO-(n0-x) +lAc-x ]/V G(t) = k [ n0 (lNa+ +lHO-)+x(lAc--lHO-) ]/V G(t) = G0 +k x(lAc--lHO-) /V.
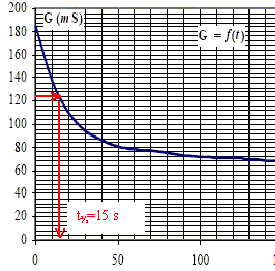
On peut exprimer l'avancement x en fonction de G(t), G0 et Goo (Goo est la conductance au bout d'un temps supposé infini) : x = n0 (G0-G) / (G0-Goo). Temps de demi-réaction. à t½, l'avancement est égal à la moitié de l'avancement final soit x½ = 0,025 mol G0= 0,184 S ; Goo =0,068 S ( lecture graphe) G½ = G0-x½ /n0(G0-Goo) = 0,184 -0,025/0,05 (0,184-0,068) = 0,126 S.
|
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||
|
|