|
|
|||
|
|||
|
(87/54 = 1,6 ; 965/36 = 27 ; 1F = 9,65 105 C mol-1)
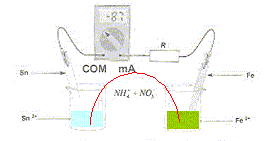
A. L' ampèremètre indique une valeur négative car il est branché en dérivation aux bornes de la pile. Faux. La valeur négative indique que la borne COM de l'ampèremètre est reliée au pôle positif de la pile. B. La plaque d'étain constitue la borne négative. Faux. La plaque de fer est la borne négative, l'étain la borne positive de la pile. C. Les ions NH4+(aq) et NO3-(aq) contenu dans le pont salin assurent le passage du courant électrique. Vrai. D. La concentration des ions Fe2+ varie de + 16 mmol/L. Faux. oxydation du fer : Fe(s) = Fe2+(aq) + 2e-. Quantité d'électricite Q= It = 0,087 *3600 = 87*3,6 C Quantité de matière d'électrons : n( e-) = Q/96500 = 87*3,6 / 96500 n( e-)= 87*36/965 10-3 =87/27 10-3 mol Quantité de matière d'ion fer (II° : n(Fe2+) = 0,5 n( e-)= 0,5*87/27 10-3 =87/54 10-3 = 1,6 10-3 mol = 1,6 mmol.
A. La formule chimique du sulfate de chrome est Cr2(SO4)3(s). Vrai. B. Le dépôt de chrome s'effectue à l'anode. Faux. La réduction des ions Cr3+(aq) s'effectue à la cathode négative. C. Lorsque le dépôt est éffectué, la quantité de matière déposée sur la pièce est 0,025 mol. Vrai. quantité de matière (mol) = masse (g) / masse molaire (g/mol) ; masse molaire du chrome M= 52 g/mol ; n = 1,3/52 =0,025 mol. D. Si le rendement était de 100 %, la durée de l'électrolyse serait de 120 min. Vrai. Cr3+(aq) + 3e- = Cr (s). quantité de matière d'électrons : n(e-) =3*0,025 = 0,075 mol. Quantité d'électricité : n(e-) *96500 = 0,075*96500 = 7,5*965 C Quantité d'électricité Q= I t d'où t = Q/I = 7,5*965 s = 7,5*965/60 min = 7,5*16 = 120 min.
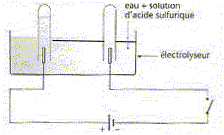
On réalise l'électrolyse d'une solution aqueuse d'acide sulfurique dans un électrolyseur. En portant des gants on retourne sur chaque électrode un tube à essai rempli de la solution. On ferme l'interrupteur et on observe des gaz qui se dégagent à chaque électrode. On poursuit l'expérience pendant 27 s sous une intensité I= 360 mA. L'équation globale de cette transformation est la décomposition de l'eau. Vm= 22 L/mol ; couples oxydant/réducteur : H+(aq)/H2 ; O2(aq) / H2O. 965/36 = 27.
A. Il s'échappe deux fois plus de dioxygène que de dihydrogène. Faux. 2H2O = 2H2 (g) + O2(g) B. Le gaz produit à la cathode ravive la flamme d'un buchette n'ayant qu'une pointe rouge incandescente. Faux. Le dihydrogène est produit à la cathode, le dioxygène à l'anode. C. Il s'est formé 1,1 mL de gaz dans le tube relié à la borne négative. Vrai. Quantité d'électricité Q = It = 0,36*27 C Quantité de matière d'électrons : n(e-) = 0,36*27/96500 =36*27/965 10-4 = 10-4 mol. 2H+ + 2e- = H2. Quantité de matière de gaz H2 : 0,5 10-4 mol. volume de gaz (L) = volume molaire (L/mol) * quantité de matière (mol) =22*0,5 10-4 = 1,1 10-3 L = 1,1 mL. D. La transformation étudiée est spontanée. Faux. L'électrolyse est une transformation forcée.
|
|||
|
|
|||
|
|