|
concours Fesic
cinétique :
iodure et peroxodisulfate ; chlorure de tertiobutyle ;
iodure et eau oxygénée ; méthanoate
d'éthyle .
2007
|
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
|
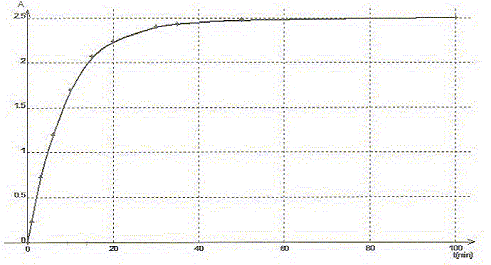
La transformation est modélisée par l'équation chimique : S2O82-(aq) + 2 I-(aq) = I2(aq) + 2SO42- (aq). Les concentrations et volumes des réactifs introduits sont les suivants : S2O82-(aq) : c1 = 0,50 mol/L ; v1 = 10,0 mL I-(aq) : c2 = 0,020 mol/L ; v2 = 10,0 mL. On a mesuré l'absorbance au cours du temps et obtenu la courbe ci-dessous : On rappelle la loi de Beer aux faibles concentrations : A = k [I2] où k est un coefficient de proportionalité.
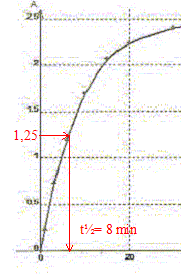
A. Le temps de demi-réaction t½ vaut environ 30 min. Faux.
B. L'ion peroxodisulfate est le réactif limitant. Faux. Quantité de matière d'ion S2O82-(aq) : c1v1 = 0,5*10 = 5 mmol Quantité de matière d'ion I-(aq) : c2v2 = 0,02*10 = 0,2 mmol à partir de 0,2 mmol d'ion I-(aq) il faut, d'après les coefficients stoechiométriques, 0,1 mmol d'ion S2O82-(aq) : or on en a 5 mmol. S2O82-(aq) est en large excès. C. La réaction étant totale, la concentration finale doit être [I2]max= 10 mmol/L. Faux. [I2]max=½[I-(aq)]initial =c2v2 /(v1+v2) =0,1/20= 5 10-3 mol/L = 5 mmol/L D. La valeur de k pour la longueur d'onde choisie est 5,0 102 L mol-1. Amax = k [I2]max ; k=Amax /[I2]max=2,5 / 5 10-3 = 500 L mol-1. Vrai.
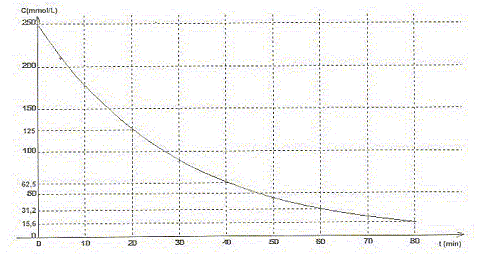
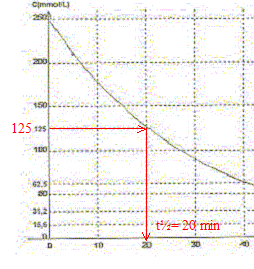
A. Le pentaoxyde de diazote est l'oxydant du couple N2O5/ NO2.Vrai. Le nombre d'oxydation de l'azote dans N2O5 vaut 5 et 4 dans NO2. B. Le temps de demi-réaction vaut t½ = 20 min environ. Vrai.
C. La concentration en pentaoxyde de diazote décroît exponentiellement.Vrai. Toutes les 20 min la concentration C est divisée par deux. D. A too le volume de dioxygène dégagé vaut 6,25 L. Faux. N2O5 = 2NO2 + ½ O2. n(O2)max = ½ n(N2O5) initiale =0,25/2 = 0,125 mol Volume final de dioxygène (L) = quantité de matière (mol) * volume molaire (L/mol) = 0,125*25=3,12 L.
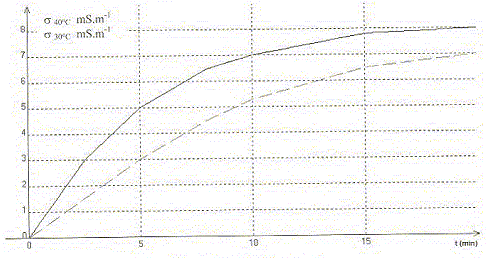
Le chlorure de tertiobutyle (CH3)3C-Cl réagit avec l'eau. La transformation est modélisée par l'équation chimique : (CH3)3C-Cl (aq) + 2H2O = H3O+ + Cl- + (CH3)3C-OH (aq) Dans deux bechers différents on prépare 360 mL d'eau. L'un est placé dans un bain thermostaté à 40 °C et l'autre à 30 °C. Quand l'équilibre thermique est atteint, on ajoute 9,25 mL de chlorure de tertiobutyle et on plonge une cellule conductimétrique dans chacun des bechers. On déclenche pendant 20 min l'enregistrement de la valeur de la conductivité s de la solution en fonction du temps. On obtient les courbes suivantes.
Chlorure de tertiobutyle : d= 0,85 ; M= 92,5 g/mol. ; eau : d=1 ; M= 18 g/mol. A. Les réactifs sont introduits en proportions stoechiométriques. Faux. Chlorure de tertiobutyle : masse : 9,25*0,85 g n= masse (g) / masse molaire (g/mol) = 9,25*0,85/ 92,5 = 0,085 mol eau : m = 360 g ; n = 360/18 = 20 mol. Soit n la quantité de matière initiale de chlorure de tertiobutyle, s la conductivité de la solution à l'instant t et soo la conductivité de la solution quand t tend vers l'infini. B. L'avancement de la
réaction peut s'écrire : x =
ns
/sooVrai. soo = lH3O+ [H3O+ ]oo+lCl- [Cl- ]oo = (lH3O++lCl-)xmax/V = (lH3O++lCl-) n/V s /soo = x/n C. Au bout de 5 min, [Cl-]30 = 60% [Cl-]40. Vrai. [Cl-]30 = x30 /V = s30/ (lH3O++lCl-)=3/(lH3O++lCl-) [Cl-]40 = x40 /V = s40/ (lH3O++lCl-)=5/(lH3O++lCl-) D. L'avancement final à 40°C, noté xf40 est supérieur à l'avancement final à 30°C, noté xf30. Faux. L'avancement final est identique et vaut n ; l'équilibre est plus rapidement atteint à 40 °C mais sa composition ne change pas.
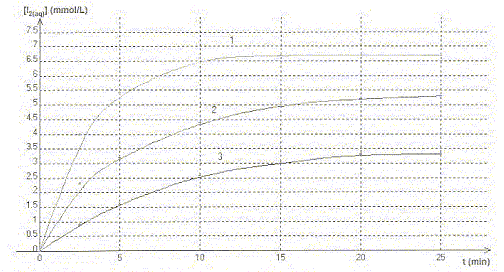
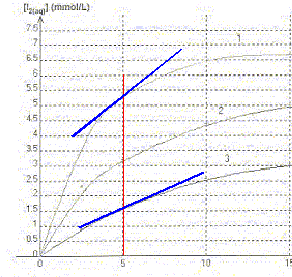
On étudie la cinétique de la réaction en milieu acide, entre les ions iodures I-(aq) provenant d'une solution d'iodure de potassium de concentration molaire c1 =0,10 mol/L et le peroxyde d'hydrogène H2O2(aq) de concentration c2 = 0,10 mol/L. La transformation est modélisée par l'équation chimique : H2O2(aq) + 2H3O+(aq) + 2 I-(aq) = 4H2O + I2(aq) On réalise trois mélanges A, B, C contenant les mêmes réactifs dans des proportions différentes
A. Dans les trois mélanges le réactif en excès est l'ion iodure. Vrai. B. La courbe 3 correspond au mélange C. Vrai. La vitesse de la réaction est d'autant plus grande que les concentrations des réactifs sont grandes. Dans le mélange C, les concentrations des réactifs sont les plus faibles des trois mélanges. La vitesse est donc la plus faible et [I2] est la plus faible. v1 et v3 sont respectivement les vitesses de réaction relatives aux courbes 1 et 3. C. à t = 5 min la valeur de v3 est supérieure à celle de v1. Faux. La vitesse est proportionnelle au coefficient directeur de la tangente à la courbe à la date considérée. Ce coefficient est d'autant plus grand que la tangente se rapproche de la verticale.
D. la courbe 2 atteindra la même limite que la courbe 1. Faux. Les conditions initiales ne sont pas identiques.
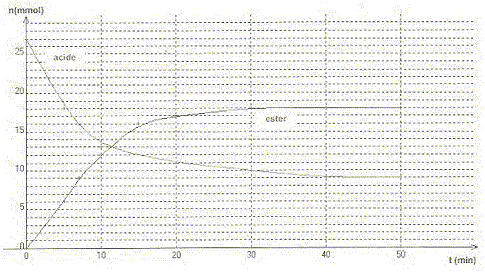
Le méthanoate d'éthyle est un ester à odeur de rhum. On le prépare à partir d'un mélange équimolaire d'acide carboxylique et d'alcool. On a tracé l'évolution de la quantité d'ester et d'acide en fonction du temps.
A. L'alcool utilisé est le méthanol. Faux. alcool éthylique et acide méthanoïque. B. La constante d'équilibre de la réaction entre l'acide et l'alcool est égale à 4. Vrai. alcool + acide = ester + eau ; K = [ester]éq[eau]éq / ([alcool]éq[acide]éq ) [ester]éq =[eau]éq =18/V ; [alcool]éq=[acide]éq =9/V ; K =18*18/(9*9)=4. C. Le taux d'avancement final de la réaction est égal à 67 %.Vrai. 18*100/27 = 67 % D. En mesurant la température d'ébullition de l'ester on peut contrôler sa pureté. Faux. La température débullition dépend de la pression.
|
|||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
|