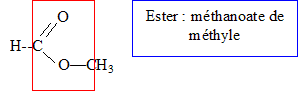|
Diplome d'accès
aux études universitaires B
Oxydoréduction
: ion permanganate et ion fer II.
chimie
2006
|
|||
|
|||
|
E°( MnO4-(aq) / Mn2+(aq) ) = 1,51V et E°(Fe3+(aq) / Fe2+(aq)) = 0,77 V M (Fe) = 56 g/mol ; Masse Molaire du sel de Mohr : 392 g/mol.
5 Fe2+ =5 Fe3++ 5e- MnO4-+ 8 H+ +5 Fe2+ =5 Fe3++Mn2++ 4 H2O On doit ajouter de l'acide sulfurique au mélange réactionnel : les ions H+ apportés par cet acide sont l'un des réactifs. De plus l'ion sulfate SO42- , introduit avec l'acide, de subit ni oxydation ni réduction. Pour préparer la solution de fer II on utilise du sel de Mohr solide de formule FeSO4,(NH4)2SO4,6H2O de masse molaire 392 g.mol-1. Masse de sel de Mohr à dissoudre dans 500 mL d'eau pour obtenir une solution de concentration C = 0,2 mol.L-1. Quantité de matière de ce sel (mol) = concentration (mol/L) * volume ( L) n = 0,2*0,5 = 0,1 mol masse (g) = quantité de matière (mol) * masse molaire (g/mol) m = n M = 0,1*392 = 39,2 g. Concentration massique en ion fer II de cette solution : FeSO4 (s) = Fe2+(aq) + SO42- (aq) [ Fe2+(aq)]=0,2 mol/L. Dans un bêcher, on
mélange : MnO4-+ 8 H+ +5 Fe2+ =5 Fe3++Mn2++ 4 H2O Qr i=[Fe3+]i5 [Mn2+]i/([Fe2+]i5[H+]i8[MnO4-]i) Volume du mélange : V= 100 mL= 0,1 L [Fe3+]i = 0,2*50/100 =0,1 mol/L [Mn2+]i=1*10/100 = 0,1 mol/L [Fe2+]i=1*10/100 =0,1 mol/L [H+]i=1*10/100 = 0,1 mol/L [MnO4-]i=0,5*20/100 = 0,1 mol/L Qr i=0,15
*0,1/(0,15*0,18*0,1) =
108.
Problème n° 2 : (3 points) Un flacon possède une étiquette avec l'intitulé " Solution Aqueuse de H - C OO - CH3 "
La réaction de saponification ou hydrolyse basique de l'ester s'écrit : H - C OO - CH3 + Na+(aq) + HO-(aq) = H-COO-(aq) + Na+(aq) +CH3OH
|
|||
|
|