|
chimie organique, calcul de pH, spectrométrie de masse, chromatographie en phase gazeuse concours Cnrs 2003 |
|||
|
|||
|
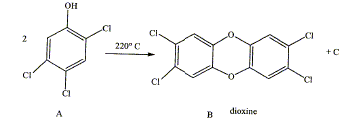
La dioxine est produite à partir du 1,2,4,5-tétrachlorobenzène antiseptique utilisé dans l'industrie pharmaceutique et c'est un intermédiaire dans la fabrication des pesticides ( contre termites).
Nommer les groupes caractéristiques (fonction chimique ) des produits A et B. Equilibrer la réaction A donnant B, quel composé C se forme ? Comment mettre en évidence la nature chimique de C ? Comment le détruire.
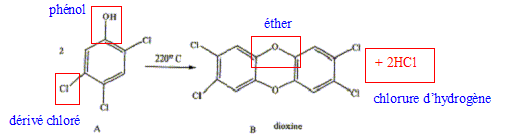
Le chlorure d'hydrogène est très soluble dans l'eau : il donne une solution d'acide chlorhydrique. Celle-ci en présence d'une base conduit à
un sel.
Soit les réactions successives suivantes : (A) CH3-CH2-CH2OH ---> (B) CH3-CH2-CHO ---> (C) CH3-CH2-COOH Donner la formule développée de ces produits. Quelles sont les fonctions chimiques de ces produits ? Ces réactions sont-elles des réactions de réduction, d'hydrolyse, de couplage, d'oxydation ? Deux produits parmi A, B, C peuvent réagir ensemble, lesquels ? Ecrire la réaction ; quel est son nom ? Est une réaction totalement déplacée, équilibrée, ne se fait pas. En cas de réponse "équilibrée", comment déplacer l'équilibre ? 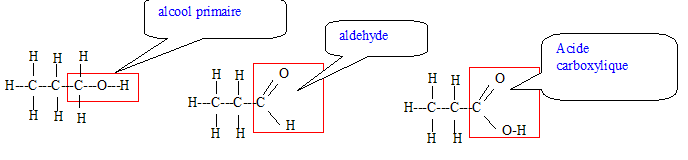
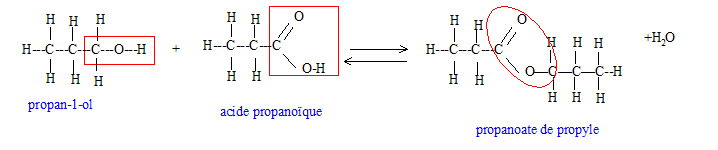
Réaction d'oxydation ménagée d'un alcool primaire en aldehyde puis acide carboxylique. L'alcool A peut réagir avec l'acide carboxylique C pour conduire à un ester et de l'eau.
La réaction d'estérification est limitée équilibrée ) par l'hydrolyse de l'ester. En utilisant un réactif en excès ( ou en éliminant l'un des produits au fur et à mesure qu'il se forme), on déplace l'équilibre vers la droite, formation de l'ester.
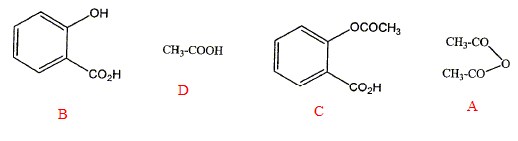
Synthèse d'un ester à partir d'un anhydride d'acide et d'un alcool. L'aspirine est préparée suivant cette réaction. L'ester C est ici l'aspirine ou acide acéthylsalicylique. (A) anhydride d'acide + (B) alcool ---> (C) ester + (D) acide carboxylique. Les produits de la réaction sont listés ci-dessous : attribuer à chacun d'eux la lettre A, B, C ou D correspondant à leur fonction.
On souhaite préparer 100 kg d'aspirine, le rendement théorique de la réaction est 95 %. Quelle masse d'acide salicylique faut-il utiliser ? (C : 12 ; H : 1 ; o : 16 g/mol)
Masse molaire de l'aspirine C9H8O4 : M = 9*12+8+4*16 = 180 g/mol Quantité de matière d'aspirine (mol) = masse (g) / masse molaire (g/mol) n(aspirine) = 100 000 / 180 = 555,56 mol D'après les coefficients stoemétriques de l'équation : n(aspirine) = n( acide salicylique) masse (g) = quantité de matière(mol) * masse molaire (g/mol) m(acide salycilique) = 555,56*138 = 76,66 kg tenir compte du rendement : 76,66 /
0,95 = 80,7
kg.
Dans un catalogue de produits chimiques on a relevé les informations suivantes : "glutaraldéhyde 25 % en solution ; C5H8O2 ; M= 100,12 g/mol ; d=1,06. Quelle est la concentration du
glutaraldéhyde en solution ?
Quantité de matière
de glutaraldéhyde en solution = masse (g) / masse
molaire (g/mol) = 265/100,12 =
2,65 mol dans 1
L.
couple
(NH4+ / NH3) :
pKa =9,26.
[NH3] /[NH4+] =5,75 On note v (mL) le volume de solution de NH4Cl ajouté : [NH4+] =0,34 v/(250+v) ; [NH3] =0,82*250/(250+v) [NH3]
/[NH4+] =0,82*250/0,34 v =
5,75 ; v= 0,82*250 /(0,34*5,75)
=105
mL.
De quelle(s) façon(s) peut-on procéder ? Le facteur de dilution est : 1/0,0005 = 2000. - 2 dilutions successives : 5 mL dans une fiole jaugée de 100 mL, puis 10 mL dans une fiole jaugée de 1000 mL Facteur de dilution : 100/5 * 1000/10 = 20*100=2000 ( correct). -2 dilutions successives : 20 mL dans une fiole jaugée de 100 mL, puis 5 mL dans une fiole jaugée de 1000 mL. Facteur de dilution : 100/20 * 1000/5 = 5*200=1000 ( incorrect). - 2 dilutions successives : 5 mL dans une fiole jaugée de 50 mL, puis 5 mL dans une fiole jaugée de 1000 mL. Facteur de dilution : 50/5 * 1000/5 = 10*200=2000 (correct). - 2 dilutions successives : 25 mL dans une fiole jaugée de 1000 mL, puis 20 mL dans une fiole jaugée de 1000 mL. Facteur de dilution : 1000/25 *
1000/20 = 40*50=2000
(correct).
pico = 10-12 ; femto = 10-15 ; nano = 10-9 ; micro = 10-6 ; atto = 10-18; déci = 0,1.
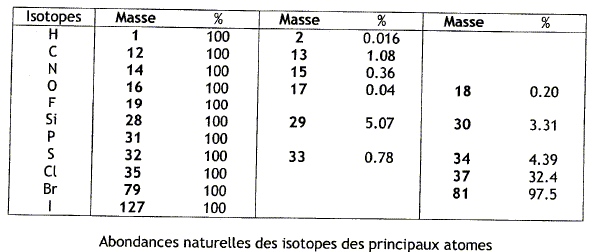
L'ionisation est une opération permettant de produire : - Un ion à partir d'un atome ou d'une molécule neutre. (correct) - un atome à partir d'un atome ou d'une molécule neutre. - Une molécule neutre à partir d'un atome ou d'un ion. Un spectromètre de masse est : - Un instrument qui analyse les molécules suivant le rapport m/z. - Un instrument qui analyse les ions suivant le rapport m/z. (correct ) - Un instrument qui analyse les composés suivant le rapport m/z. Lors de l'analyse par spectromètrie de masse, on produit des ions moléculaires, de quoi s'agit-il ? - Un ion issu d'une molécule par perte ou gain d'un proton. - Un ion issu d'une molécule par perte ou gain d'un électron. (correct) - Un ion issu d'une molécule par perte ou gain d'un neutron. L'analyse par spectromtrie de masse du benzène permet de détecter un pic intense à M= m/z = 78, ceci correspnd au pic de base du spectre. Un pic plus petit apparaît à M+1 = 79. Comment expliquer la présence de ce pic ? Quelle est son abondance relative ?
La présence de ce pic est dues aux isotopes du carbone ( 13C : 1,08%) et de l'hydrogène ( 2H : 0,016%). Abondance relative : 1,08+0,016 =
1,1 %.
La grandeur expérimentale caractéristique est le temps de rétention, cette grandeur est-elle dépendante ou indépendante des paramètrs suivants : - Débit du gaz porteur ( dépendant) - Quantité injecée ( indépendante) - Nature et abondance des autres constituants, s'ils sont bien séparés ( indépendante). - Phase stationaire ( dépendant) - Température de la colonne
( dépendant).
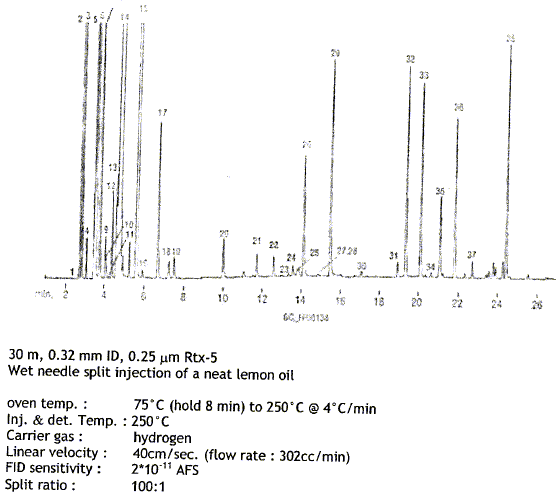
La colonne est-elle polaire, apolaire ? apolaire.( 5% diphényl : substituant apolaire) Parmi les 38 composés détectés, attribuer l'ordre de sortie aux composés suivants ( la valeur indiquée entre parenthèse correspond à la température d'ébullition) limonène (176° ), géraniol (230° ), nérol (224°), linalol (198°), camphène (159°). Séparation des produits suivant leur point d'ébullition ; les composés ayant les points d'ébullition les plus élevés sont les plus polaires. Ils présentent peu d'affinité pour la phase fixe d'où l'ordre de sortie : géraniol, nérol, linalol, limonène, camphène. Le temps de rétention du composé 33 est de 20 min, quelle est la température du four ? Quel type de détecteur a été utilisé ? détecteur à ionisation de flamme : très sensible Citez trois autre détecteurs utilisables en chromatographie en phase gazeuse. - détecteur électrique, basé sur le principe du pont de Wheatstone ( catharomètre ) - détecteur à absorption électronique - spectromètre de masse et la spectroscopie infrarouge. |
|||
|
|
|||
|
|