|
acide sulfurique, pile nickel argent, réactions nucléaires et radioactivité concours technicien chimiste cnrs 2006 |
|||
|
|||
|
Quelle est la formule brute de l'acide sulfurique ? H2SO4. Quelle est la masse molaire de l'acide sulfurique ? ( H : 1 ; S : 32 ; O : 16 g/mol) M= 2+32+4*16 = 98 g/mol. Quelle est la molarité de cette solution ? Masse de 1 L de solution commerciale : 1840 g Masse d'acide pur : 1840*0,98 = 1803.2 g Quantité de matière (mol) dans 1 L : 1803,2 / 98 = 18,4 mol/L. Quelle est la normalité de cette solution ? L'acide sulfurique est un diacide d'où : 2*18,4 = 36,8 N. Quel volume d'acide cncentré allez-vous prélever pour fabriquer 1 L de solution environ 1 N ? 1000 / 36,8 = 27,2 mL. Décrire le mode opératoire pour préparer 1 L de solution 1 N. Prélever 27,2 mL de solution commerciale à l'aide d'une pipette ou d'une burette graduée. Placer dans une fiole jaugée de 1 L contenant un peu d'eau distillée. Compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène. La solution est-elle directement utilisable pour faire un dosage ou faut-il la titrer ? Pour réaliser un dosage précis, cela nécessite des solutions de concentrations connues avec précision. Or la solution préparée est environ 1N. Il faut donc la titrer avec une solution de soude de concentration connue et précise.
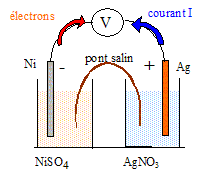
Soit une pile standart constituée à droite d'un fil d'argent plongeant dans une solution de nitrate d'argent [Ag+]= 1mol/L et à gauche d'un fil de nickel plongeant dans une solution de sulfate de nickel [Ni2+]= 1 mol/L. La différence de potentiel lue entre les deux électrodes est positive. E°(Ag+/Ag )=0,80 V ; E°(Ni2+/Ni )= -0,23 V. Ag : 107,9 ; Ni : 58,7 g/mol. Faire le schéma annoté de la pile. Préciser le sens de circulation du courant et le sens de circulation des électrons.
Ecrire les équations des réactions se produisant à chaque électrode ainsi que la réaction bilan associée à a pile. A l'anode négative, oxydation du nickel : Ni = Ni2+ + 2e-. A la cathode positive, réduction des ions Ag+ : 2Ag+ + 2e- = 2 Ag. 2Ag+ +Ni = Ni2+ +2 Ag. Quelle est la variation de masse de l'électrode constituant le pôle négatif de la pile lorsque celle-ci débite un courant d'intensité constante I= 10 mA pendant 3 heures ? Ni = Ni2+ + 2e-, la masse de nickel diminue. Quantité d'électricité : Q= It avec I = 0,01 A et t = 3*3600 = 10800s Q= 0,01*10800 = 108 C Quantité de matière d'électrons : n(e-) = Q/96500 = 108/96500 = 1,12 10-3 mol. D'après les nombres stoechiométriques, n(Ni) = 0,5 n(e-) =5,6 10-4 mol. masse (g) = masse molaire (g/mol) * quantité de matière (mol) m = 58,7*5,6 10-4 =3,28 10-2 g.
1H ; 2He ; 6C ; 7N ; 8O. Le proton est reprsenté par 11H. Justifier cette écriture. Le proton ou noyau de l'élément hydrogène compte 1 proton ( donc 1 nucléon et une charge). l'équation de la réaction qui a lieu lorsque le neutron rapide éjecte un des protons du noyau d'azote peut s'écrire : 10n + 147N --->AZX1+ 11H. Enoncer les lois de conservation qui régissent une réaction nucléaire et vérifier que AZX1 est du carbone 14. Conservation de la charge : 0+7= Z+ 1 d'où Z=6 ( élément carbone) Conservation du nombre de nucléons : 1+14 = A+1 d'où A= 14. Qu'est ce qu'un isotope ? Deux noyaux isotopes ont le même numéro atomique Z, mais des nombres de neutrons différents. Le carbone 14 est radioactif : il se décompose en émettant un électron et en donnant un noyau X2. Sa période ou demi-vie est 5570 ans. Ecrire l'équation de la décomposition du carbone 14 en précisant le type de radioactivité. 146C---> 147N +0-1e ; type b-. Le noyau fils est un noyau d'azote. Donner la définition de la demi-vie t½. La demi-vie est la durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. Etablir la relation entre t½ et la constante radioactive l. Loi de dcroissance radioactive : N(t) = N0 exp(-lt). N(t½) = 0,5 N0 = N0 exp(-lt½). 0,5 = exp(-lt½) ; ln 0,5 = -lt½ ; lt½ = ln2. |
|||
|
|
|||
|
|