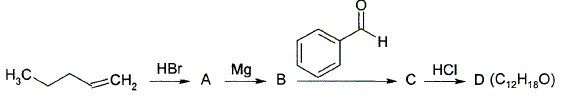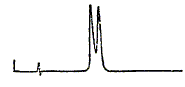|
concours cnrs
sécurité;
dilution, conformation en chimie organique, HPLC, RMN.
Technicien de
recherche Ile de France 2003
|
|||
|
|||
|
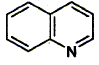
1 : explosif ; 2 : toxique ; 3 : corrosif ; 4 : substance inflammable 5 : matière radioactive ; 6 : danger électrique ; 7 : champ magnétique important ; 8 : maetière nocive ou irritante 9 : radiations non ionisantes ; 10 : comburant ; 11 : tayonnement laser ; 12 : basse température. Citer trois moyens de protection individuelle utilisés dans un laboratoire de chimie : port de blouse, port de lunettes de protection, port de gants. Pour abaisser le pH d'une solution aqueuse il faut : - ajouter un acide - ajouter une base. ( dans ce cas le pH augmenterait ) Sur l'étiquette d'un flacon d'acide sulfurique concentré, on trouve les indications suivantes : PM : 98,07 ; d=1,84 ; titre : 97 %. Quel volume d'acide sulfurique concentré faut-il prélever pour réaliser 1 L de solution titrant 0,73 mol/L ? masse de 1 L de solution concentrée : 1,84 kg =1840 g masse d'acide pur dans ceet solution : 1840*0,97 =1785 g quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 1785 / 98,07 =18,2 mol volume à prélever : 0,73/18,2 = 0,040 L = 40 mL. Décrivez l'ordre des opérations si vous disposez du matériel suivant : éprouvette graduée de 100 mL et de 100 mL ; pipette jaugée de 20 mL; fiole jaugée de 1000 mL; eau distillée. Placer dans la fiole jaugée un peu d'eau distillée ; prélever 40 mL de la solution concentrée à l'aide de la pipette jaugée + pipeteur. Placer dans la fiole jaugée de 1L et compléter avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre homogène. Ecrire la formule brute et calculer la masse molaire de la quinoléine : C : 12 ; N : 14 ; O : 16 ; H : 1 g/mol.
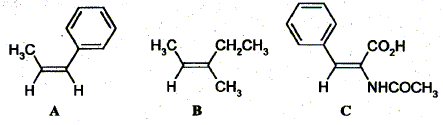
Formule brute : C9 H7N ; M = 9*12+7+14 =129 g/mol. Attribuer la configuration Z ou E des oléfines suivantes :
Les groupes portés par chaque carbone doublement liés sont classés par priorité décroissante en utilisant les règles de Cahn, Ingold et Prelog. - Les atomes sont classés par numéro atomique décroissant. En cas d'égalité on passe aux atomes qui leurs sont liés ( atomes de second rang) et ainsi de suite. A : CH3 et C6H5 , groupes prioritaires,sont situés du même côté : configuration Z. B : CH3 et CH2CH3 , groupes prioritaires,sont situés du même côté : configuration Z. C: NHCOCH3 et C6H5 , groupes prioritaires,sont situés de part et d'autre : configuration E.
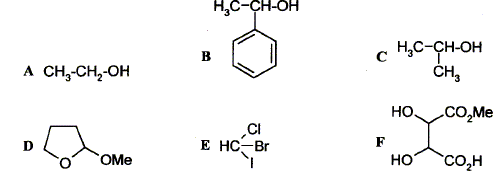
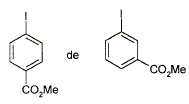
Parmi les molécules suivantes indiquez celles qui sont chirales :
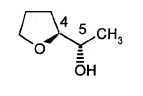
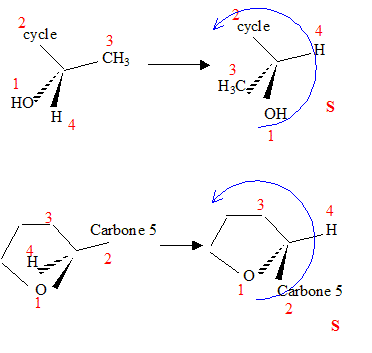
carbone asymétrique : carbone tétragonal lié à 4 groupes différents. La présence d'un carbone asymétrique indique qu'une molécule est chirale. B possède un carbone asymétrique ( celui porteur du groupe OH) : B est chirale. D possède un carbone asymétrique ( celui porteur du groupe OMe) : D est chirale. E possède un carbone asymétrique : E est chirale. F possède deux carbones asymétriques : F est chirale. Donnez la configuration absolue des atomes de carbone 4 et 5 en indiquant l'ordre de priorité pour chaque carbone.
Donnez la structure des composés A, B, C et D.
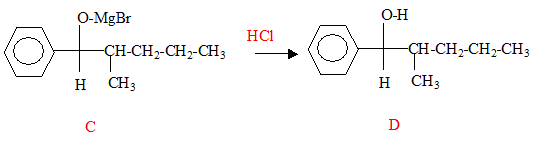
L'addition de HBr sur la double liaison donne le 2-bromopentane CH3-CHBr-CH2-CH2-CH3. Passage au magnésien B : CH3-HC(MgBr)-CH2-CH2-CH3. L'addition du magnésien sur le carbonyle donne :
Citez trois moyens de purification en chimie organique : recristallisation ; précipitation sélective, extraction par solvants, chromatographie. Classez dans l'ordre les longueurs d'onde croissantes les rayonnements suivants : U.V ( l < 400 nm ) ; visible ( 400 nm< l <800 nm ); I.R ( l >800 nm ). Parmi les couples de solvants suivants, indiquez ceux qui ne sont pas miscibles : eau- acétonitrile ; eau -
méthanol ;
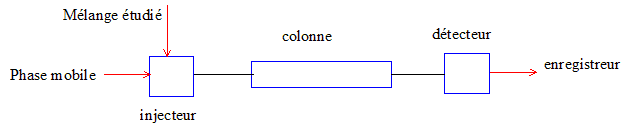
Dessiner le schéma simplifié d'un appareillage de chromatographie liquide à haute performance ( HPLC) en précisant le nom de chaque composant.
Quel type de détecteur ne peut pas être utilisé en HPLC ? UV/visible ; réfractomètre ;
Quel type de détecteur peut on utiliser en chromatographie en phase gazeuse ? UV/visible ; réfractomètre ; catharomètre ; ionisation de flamme ; spectromètre de masse ; électrochimique. Chromatographie en phase gazeuse : Classer par ordre croissant des temps de rétention sur une colone apolaire des composés suivants : méthanol ; nitrobenzène ; toluène ; éther. Sur une colonne apolaire, les molécules les plus polaires sortent en premier ( temps de rétention les plus faibles ): méthanol ; nitrobenzène ; éther ; toluène. Parmi les techniques d'analyse
suivantes, cocher celles qui ne permettent pas de
différencier : Analyse élémentaire ; RMN 1H ; RMN13C ; point d'ébullition ; pouvoir rotatoire ; absorption UV. Un échantillon de 4-phényl-2-butanol a été préparé par réduction à l'aide d'alumino hydrure de lithium de la cétone correspondante. Les analyse RMN et masse montrent que le produit a une grande pureté, une HPLC sur une colonne particulière à base d'un dérivé de cellulose donne le chromatogramme suivant, dont les deux pics ont la même surface.
Donner la formule semi-développée du 4-phényl-2-butanol . Pouvez vous expliquer ce résultat ? C6H5-CH2-CH2-*CHOH-CH3. Il existe un carbone asymétrique, donc deux isomères optiques. La réduction conduit au mélange racémique. Deux solutés homologues donnent le chromatogramme suivant en utilisant le mélange eau acétonitrile et une phase greffée C18.
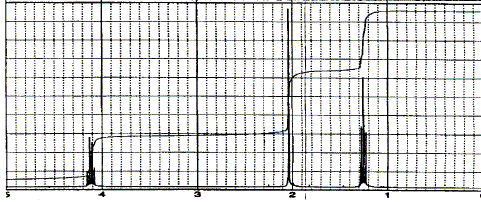
Pour améliorer la séparation il faut : - augmenter la concentration en eau de la phase mobile ; - augmenter la cencentration en acétonitrile de la phase mobile ;- augmenter le débit de la phase mobile. Les deux solutés ont des polarités voisines et la phase fixe est apolaire. Pour améliorer la séparation il faut diminuer la polarité de la phase mobile, donc ajouter de l'acétonitrile ( moins polaire que l'eau ). On veut effectuer une analyse quantitative sur un mélange inconnu qui donne ce chromatogramme avec un détecteur UV : 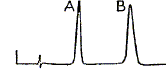
En première approximation il est possible
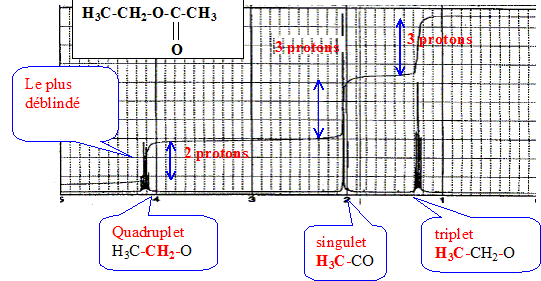
d'affirmer que : Les pics ont la même hauteur, mais les bases sont différentes : les aires des pics sont différentes et les concentrations sont différentes. Le spectre RMN du proton a été enregistré à 300 MHz en solution dans CDCl3 avec le TMS comme référence.
Il n'y a aucun pic en dehors de la zone 0 à 5 ppm. Quel est le signal le plus déblindé ? Quels serait les déplacements chimiques des signaux à 400 MHz ? De quel composé de formule brute C4H8O2 s'agit-il ? A 400 MHz les déplacements chimiques relevés sur le spectres seraient multipliés par 3/4.
|
|||
|
|
|||
|
|