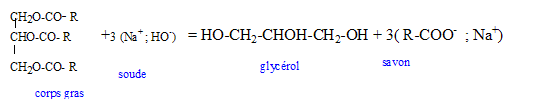|
Concours Kiné : synthèse d'un détergent 2007 ( Ceerrf) |
|||
|
|||
|
Question1 : 10 pts/20 sans calculatrice
Dans le ballon la saponification du triester a lieu.
Masse molaire du triester : quantité de matière initiale : n(T) = m/M = 18/M mol quantité de matière initiale de soude : n0= 4/40 = 0,1 mol quantité de matière d'acide versé lors du dosage : 2*16,5 10-3 = 0,033 mol quantité de matière de soude en excès : 0,033 mol quantité de matière de soude ayant réagit avec le triester : 0,1-0,033 = 0,067 mol quantité de matière de triester : n(T) = 0,067/3 = 2,23 10-2 mol. par suite 18/M= 2,23 10-2 soit M= 18/2,23 10-2 = 806 g/mol. Masse molaire et formule semi-développée de l'acide gras saturé qui a servi à préparer le triester : Formule brute du triester : C6H5O6R3. M= 12*6+5+6*16+3MR = 806. MR = 211 g/mol formule de l'acide gras : R-COOH de masse molaire : 211+12+32+1 =256 g/mol. Formule brute de l'acide gras saturé : CnH2nO2 ; M=12n+2n+32 = 256 ; n = 16 CH3-[CH2]14-COOH. Formule du solide recueilli après filtration : CH3-[CH2]14-COO- + Na+. Ce solide a des propriété détergentes.
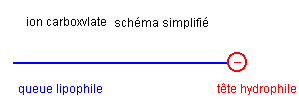
L’ion carboxylate du savon possède une extrémité négative attirée par l'eau. Cette extrémité est hydrophile (amie de l'eau). L'ion carboxylate possède également une chaîne carbonée lipophile (amie des lipides ). L'ion carboxylate possèdant une partie lipophile et une partie hydrophile est un amphiphile. La partie hydrophile est lipophobe (peur des lipides) et la partie lipophile est hydrophobe (peur de l'eau).
|
|||
|
|
|||
|
|