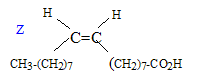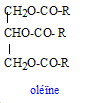|
concours électroradiologie médicale fabrication d'un savon à l'huile d'olive. Caen 2007 |
|||
|
|||
|
L'huile d'olive et l'acide oléique : L'huile d'olive est un corps gras qui contient principalement de l'oléine : triester du glycérol et de l'acide oléique.
Mode opératoire : introduire 10 g d'oléine dans un ballon de 100 mL surmonté d'un réfrigérant et équipé d'un agitateur. Ajouter ensuite une solution obtenue en dissolvant 10 g d'hydroxyde de sodium ( soude) dans 40 ml d'un mélange à volumes égaux d'eau et d'éthanol. Agiter et chauffer à reflux pendant 45 min. Ensuite verser rapidement le mélange réactionnel chaud sur une solution concentrée et froide de chlorure de sodium. Agiter le tout pendant quelques minutes et laisser refroidir. Filtrer sur buchner en versant d'abord le plus possile de liquide. laver à l'eau glacée et sécher. le produit sec obtenu a une masse de 9,8 g.
L'huile d'olive et l'acide oléique : L'huile d'olive est un corps gras qui contient principalement de l'oléine : triester du glycérol et de l'acide oléique. Un corps gras est un ester (ou un triester) obtenu à partir d'un acide carboxylique à chaine linéaire et contenant un grand nombre d'atome de carbone. Formule semi-développée du glycérol ( propane-1,2,3-triol ) : HO-CH2-CHOH-CH2OH. L'acide oléique a comme formule C17H33 COOH. Sa chaine carbonée est linéaire et présente une double liaison, dans la configuration Z, entre les atomes de carbone 9 et 10.
Formule semi-développée de l'oléine. On notera R - la chaîne C17H33 -.
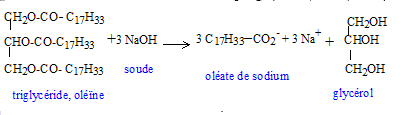
B. Préparation du savon : Mode opératoire : introduire 10 g d'oléine dans un ballon de 100 mL surmonté d'un réfrigérant et équipé d'un agitateur. Ajouter ensuite une solution obtenue en dissolvant 10 g d'hydroxyde de sodium ( soude) dans 40 ml d'un mélange à volumes égaux d'eau et d'éthanol. Agiter et chauffer à reflux pendant 45 min. Ensuite verser rapidement le mélange réactionnel chaud sur une solution concentrée et froide de chlorure de sodium. Agiter le tout pendant quelques minutes et laisser refroidir. Filtrer sur buchner en versant d'abord le plus possile de liquide. laver à l'eau glacée et sécher. Le produit sec obtenu a une masse de 9,8 g. La réaction entre le triester et l'hydroxyde de sodium est une saponification.
Les caractéristiques de cette réaction. lente, totale. Pourquoi surmonte t-on le ballon d'un réfrigérant ? Pour éviter les pertes de matière : les
vapeurs se condensent dans le réfrigérant et
retombent dans le milieu réactionnel. "verser rapidement le mélange réactionnel
chaud sur une solution concentrée et froide de
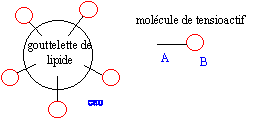
chlorure de sodium." Transfert de phase : l'ion hydroxyde est soluble dans l'eau et dans l'éthanol ; le triester est peu soluble dans l'eau mais soluble dans l'éthanol. Les deux réactifs sont ainsi mis en contact. Rendement. n( oléine) = m/M = 10 / 884 = 1,13 10-2 mol On peut espérer obtenir 3*1,13 10-2 = 3,39 10-2 mol de savon masse de savon : m= nM = 3,39 10-2*304 = 10,3 g rendement : masse expérimentale / masse théorique * 100 = 9,8/10,3*100 = 95 %. Le savon est une espèce amphiphile : La longue chaine carbonée possède des propriétés lipophiles ( elle fixe les graisses) Le groupe -COO- possède des propriètés hydrophiles : cette extrèmité entraîne les graisses, fixées sur la partie lipophile, dans l'eau.
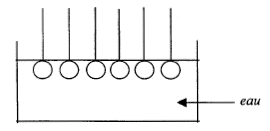
partie hydrophile : groupe COO- symbolysé par "O" et partie hydrophobe de cet ion : la chaîne carbonée symbolysée par "---------". ions carboxylates à la surface de l'eau :
ions carboxylate sur une tache de graisse (lipide) :
|
|||
|
|