corrigé
espèces chimiques initialement
présentes en solution
:
H2O, Cu2+ et Br-.
A l'anode
positive, les ions Br- s'oxydent en
Br2 rouge brun.
2Br-
= Br2 + 2e-.
A la cathode
négative, les ions Cu2+ se
réduisent en Cu(s).
Cu2+
+ 2e-= Cu(s)
équation de la
réaction associée à
l'électrolyse :
Cu2+
+2Br- = Br2 + Cu(s)
Si la tension imposée
à l'électrolyseur est beaucoup plus
importante, on observera l'oxydation de l'eau en
dioxygène à l'anode et la réduction de
l'eau en dihydrogène à la cathode.( ces
dégagements de H2 et O2
permettent de repérer visuellement ce
phénomène).
|
Schéma
de la pile Daniell
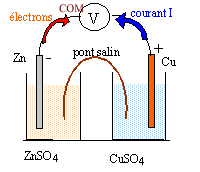
|
Schéma
annoté d'un circuit électrique
permettant de déterminer la
caractéristique de cette pile.
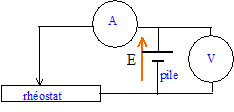
|
à
l'anode négative, le zinc s'oxyde : Zn (s) =
Zn2+ + 2e-.
à la
cathode positive, les ions Cu2+ se
réduisent : Cu2+ + 2e- =
Cu(s).
Dans les
plaques métalliques et dans les fils de cuivre, les
électrons assurent le passage du courant.
Rôle
du pont salin : assure la continuité
électrique et assure
l'électroneutralité des solutions.
Dans les
solutions et le pont salin les ions assurent le passage du
courant électrique.
solution
ZnSO4 : migration des ions sulfate
SO42- vers la droite.
La
concentration en ion Zn2+ augmente ; pour assurer
l'électroneutralité de la solution, migration
des ions Cl- du pont salin vers le bécher
de gauche.
solution
CuSO4 : migration des ions sulfate
SO42- vers la droite.
La
concentration en ion Cu2+ diminue ; pour assurer
l'électroneutralité de la solution, migration
des ions K+ du pont salin vers le bécher
de droite.
Le pont
salin est réalisé simplement en utilisant une
bande de papier buvard imprégé de KCl. ( on
peut aussi réaliser un gel conducteur dans un tube de
verre en forme de U)
fem de la pile :
E°(Cu2+/Cu) -E°(Zn2+/Zn) =
0,34-(-0,76)=1,1 V.
réaction globale de la
pile : Zn
(s) + Cu2+ = Zn2+ + Cu(s).
le réactif limitant
:
quantités
de matière initiales : n(Zn) = m/M= 2/65,4 = 0,031
mol ; n(Cu) = 2/63,5 = 0,031 mol
n(Cu2+)=n(Zn2+)=
c V = 0,2*0,1 = 0,02 mol
|
|
avancement (mol)
|
Zn
(s)
|
+
Cu2+
|
=
Zn2+
|
+
Cu(s)
|
|
initial
|
0
|
0,031
|
0,02
|
0,02
|
0,031
|
|
en cours
|
x
|
0,031-x
|
0,02-x
|
0,02+x
|
0,031+x
|
|
fin
|
xfin
|
0,031-xfin
|
0,02-xfin
|
0,02+xfin
|
0,031+xfin
|
si Zn en défaut :
0,031-xfin
= 0 soit xfin
= 0,031 mol
si
Cu2+ en défaut :
0,02-xfin
= 0 soit xfin
= 0,02 mol ( Cu2+ constitue le réactif
limitant)