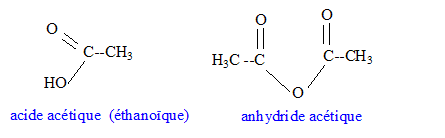|
Aide technique laboratoire ( d'après concours 2006) synthèse d'un ester ; dosage d'un déboucheur d'évier. |
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
Le linalol et l'anhydride acétique constituent les matières premières de la synthèse. On obtient de l'acétate de linalyle et de l'acide acétique. linalol + anhydride acétique
= acétate de linalyle + acide
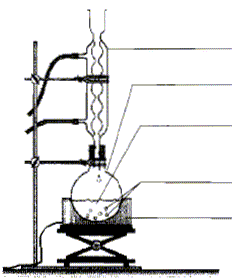
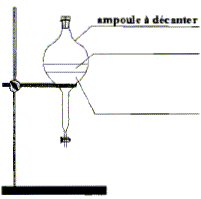
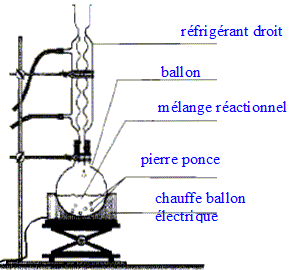
acétique On introduit dans un ballon 8,0 mL d'anhydride acétique et quelques billes de verre. Ajouter dans le ballon 4,0 mL de linalol mesurés à l'aide d'une pipette graduée. Chauffer le mélange à reflux pendant 40 min. Arrêter le chauffage et retirer le chauffe ballon. Laisser refroidir le mélange en maintenant la circulation d'eau. étape n°2 extraction de l'écétate de linalyle : Préparer environ 30 mL d'eau distillée froide dans un bécher de 100 mL. Verser doucement en agitant le contenu du ballon dans le bécher : destruction de l'anhydride &cétique en excès. Transvaser le contenu du bécher dans une ampoule à décanter. Agiter et laisser décanter. étape n°3 éliminer la phase aqueuse : Eliminer la phase aqueuse. Verser progressivement 30 mL de solution d'hydrogénocarbonate de sodium à 5 % qui réagit avec l'acide éthanoïque restant pour donner de l'acétate de sodium et CO2. Attendre que le dégagement gazeux ralentisse et mettre le bouchon sur l'ampoule à décanter. Agiter plusieurs fois, dégazer, laisser décanter. Eliminer la phase aqueuse et vérifier que le pH de celle-ci est basique. Ajouter 30 mL d'eau distillée au contenu de l'ampoule. Agiter, laisser décanter afin de laver la phase organique. Eliminer de nouveau la phase aqueuse et verser la phase organique dans un becher propre. Ajouter une spatule de chlorure de calcium anhydre.
Analyse du protocole :
Analyse du produit obtenu :
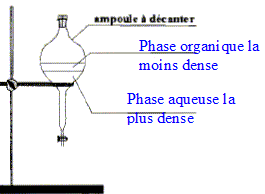
corrigé Densité d'un liquide ou d'un solide par rapport à l'eau : masse d'un certain volume du liquide ( ou du solide) divisée par la masse du même volume d'eau. C'est le rapport de deux masses ; la densité est un nombre sans unité. mélange eau-linalol : Le linalol est on miscible à l'eau ; la densité de l'eau est 1 ; la densité du linalol est 0,87 : le liquide le plus dense occupe la partie inférieure ; le linalol, le moins dense, se trouve au dessus de l'eau. Solubilité massique d'une espèce par rapport à l'eau : masse maximale de solide que l'on peut dissoudre dans un litre d'eau à une température donnée. La solubilité dépend de l'espèce chimique et de la température. Formules semi-développées de l'anhydride acétique et de l'acide acétique :
Analyse du protocole : Mesures de sécurité à respecter pour prélever 8 mL d'anhydride acétique, liquide toxique et corrosif : port de blouse, gants, lunettes et travail sous hotte. Quantités de matière initiales de linalol et d'anhydride acétique : masse (g) = volume (mL) * densité ; puis quantité de matière (mol) = masse (g) / masse molaire (g/mol) linalol : m = 4*0,87 = 3,48 g ; n = 3,48 / 154 = 2,3 10-2 mol anhydride acétique : m= 8*1,08 =8,64 g ; n = 8,64 / 102=8,5 10-2 mol La réaction se fait mole à mole entre ces deux réactifs : l'anhydride acétique est en excès. Introduire un réactif en excès dans une synthèse : La concentration des réactifs étanr un facteur cinétique, on augmente la vitesse de la réaction. Dans le cas où le système aboutit à un équilibre, on déplace l'équilibre dans le sens direct.
le verbe "décanter " signifie : laisser les espèces non miscibles se séparer par ordre de densité décroissante. Il dégazer régulièrement pour éviter une surpression dans l'ampoule à décanter. On ajoute du chlorure de calcium anhydre à la phase organique afin d'éliminer toute trace d'eau de cette phase. Analyse du produit obtenu : Technique permettant de purifier le produit de synthèse obtenu : recristallisation Une chromatographie permet de séparer et d'identifier les constituants d'un mélange. L'éluant doit permettre une bonne séparation des différentes espèces.
|
|||||||||||||||||||||||||||||||||||
|
Le but est de vérifier les
indications portées par l'étiquette. On désire préparer 200 mL d'une solution du produit dilué 40 fois. Soit S cette solution.
corrigé On désire préparer 200 mL d'une solution du produit dilué 40 fois. Soit S cette solution. Volume du produit à prélever pour préparer S : Le facteur de dilution est
égal à 40 ; le volume de la pipette
jaugée est égale à : volume de la fiole
jaugée / 40 = 200 / 40 =
5,0
mL. produit corrosif, donc port de
blouse, lunette et gants. prélever 5,0 mL de solution du commerce ( pipette jaugée + pipeteur) Placer dans une fiole jaugée de 200 mL contenant un peu d'eau distillée ; compléter jusqu'au trait de jauge avec de l'eau distillée. Agiter pour rendre homogène.
On obtient Véq =
13,7 mL. La détermination de la concentration
CS en hydroxyde de sodium de la solution S se
calcule à partir de la relation suivante : Concentration molaire c0 en hydroxyde de sodium de la solution commerciale = 40 CS= 40*0,171 = 6,85 mol/L soit en masse : 6,85*40 =
274
g d'hydroxyde de sodium
dans 1 L "solution à 20% en masse" soit 0,2*1280 = 256 g d'hydroxyde de sodium dans 1 L. écart relatif : (274-256)/256*100 = 7 % accord entre l'indication de l'étiquette et le résultat du dosage, l'écart relatif étant assez faible.
|
|||||||||||||||||||||||||||||||||||
|
|