|
Concours Kiné : étude d'un monoalcool 2007 ( Assas) |
|||
|
|||
|
Question
2 : 5points
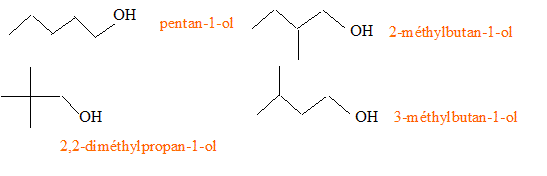
12x / 68,2 = y / 13,6 = 16 / 18,2 = M /100 d'où M= 16*100/18,2 = 88 g/mol x= 0,88*68,2/12 = 5 ; y=0,88*13,2 = 12 C5H12O. Le produit organique obtenu lors de l'oxydation ménagée ne réagit ni avec la 2,4-DNPH, ni avec le réactif de Tollens : ce produit n'est ni un aldehyde, ni une cétone. Il s'agit donc d'un acide carboxylique résultant de l'oxydation ménagée d'un alcool primaire. Formule topologique de tous les isomères qui pourraient correspondre à A :
4 fois{MnO4- + 5 électrons +8 H+ = Mn2+ + 4 H2O}. 5 fois{ C5H12O + H2O= C5H10O2 + 4H+ + 4 électrons}. 4MnO4- +5C5H12O + 12H+ =4Mn2+ + 5 C5H10O2 + 11H2O A l'équivalence, d'après les nombres stoechiométriques : n( alcool) = 1,25 n(MnO4-) . n(MnO4-) = concentration * volume ajouté à l'équivalence = 0,02* 16 = 3,2 mmol d'où n( alcool) = 1,25 *3,2 = 4 mmol dans 20 mL. Concentration molaire volumique en soluté apporté de la solution A : 4/20 = 0,20 mol/L.
|
|||
|
|
|||
|
|