|
Concours assistant d'ingénieur : isotopes du carbone; nombres quantiques; acide ascorbique 2004 ( Lille) |
||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Exercice
1 :
%12C + %13C/+ %14C = 100 ; %12C(1+1,12 10-2+1,21 10-14 =100 ; %12C =98,9 ; %13C =1,1 % ; %14C =1,2 10-12%. Quantité de matière de CO2 : n= PV/(RT) avec P= 1,013 105 Pa ; V = 10-4 m3 ; T= 25+273 = 298 K ntotal = 1,013 105 *10-4 / (8,31*298) =4,1 10-3 mol. n(12CO2)=4,1 10-3 *0,989 = 4,05 10-3 mol ; n(13CO2)=4,1 10-3 *0,011 = 4,51 10-5 mol ; n(14CO2)= 4,9 10-15 mol ; nombre d'atomes de 14C, 13C, 12C et 16O présents dans 100 mL de CO2 : multiplier les résultats
précédents par NA= 6,02
1023 mol-1. 13C ;
16O ; 16O 13C ;
17O ; 16O 14C ;
16O ; 16O Exercice
2 :
l : nombre quantique secondaire ou azimutal ; il prend toutes les valeurs entières 0, 1 , 2.... n-1. m : nombre quantique magnétique : il prend toutes les valeurs entières comprises entre - l et +l . n : nombre quantique de spin : il peut prendre deux valeurs +½ ; -½. Un électron d'un atome connu est caractérisé entre autre par n=4 et m=2. Les propositions ci-dessous sont-elles exactes ? Justifier. - Cet électron est dans une
orbitale p.
faux
(si m= 2 alors l
est supérieur ou
égal à 2 ; une orbitale p correspond à
l
=1) d : n=3 ; l =2 ; m=2 ; s=+½ ou ½. d : n=4 ; l =2 ; m=2 ; s=+½ ou ½. f : n=4 ; l =3 ; m=2 ; s=+½ ou ½. d : n=5 ; l =2 ; m=2 ; s=+½ ou ½. f : n=5 ; l =3 ; m=2 ; s=+½ ou ½.
Exercice
3 :
M( SiO2) = 28,086 + 2*15,9994 = 60,0848 g/mol. n (SiO2)=m / M = 0,1512 / 60,0848 = 2,52 10-3 mol. Masse de silicium : 2,52 10-3 *28,086 = 7,1 10-2 g Teneur en Si : 100*7,1 10-2 / 0,5 = 14,2 %. Erreur relative = (valeur maxi - valeur mini )/ valeur moyenne *100 = (0,1514-0,1509)/0,1512 *100 = 0,33% ( acceptable) Consignes de sécurité pour manipuler HF : port d'une combinaison spéciale, port de gants appropriés, port d'un appareil de protection des yeux / du visage.
Exercice
4 :
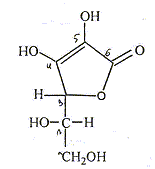
acide ascorbique : acide faible C6H7O6 -
= C6H6O6
2- + H+ Ka2 = 2,7
10-12.
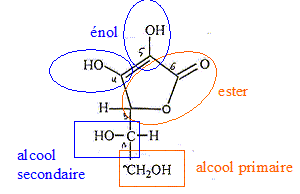
L'hydrogène du groupe énol ( carbone 4) correspond au premier équilibre acido-basique : cet hydrogène est d'autant plus acide que l'ion énolate, la base conjuguée, est stabilisée par résonance. pH de la solution initiale : C6H8O6 +H2O= C6H7O6 - + H3O+ ; Ka1= [H3O+][C6H7O6 -] / [C6H8O6 ] solution électriquement neutre : [H3O+]=[C6H7O6 -] acide peu dissocié : [C6H8O6 ] voisin de c. d'où [H3O+]2 = Ka1c ; 2 log [H3O+] = log Ka1 + log c ; pH= ½( pKa1 +logc) = 0,5( -log (6,8 10-5) - log0,1) ; pH= 2,6. Volume de soude requis pour atteindre l'équivalence : HO- + C6H8O6=C6H7O6 - +Na+. à l'équivalence CaVa = CbVb ; Vb = CaVa =/ Cb =0,1*50/0,2 = 25 mL. pH de la solution après addition de 12,5 mL de soude : Dosage base forte acide faible : à la demi-équivalence le pH est égal à pKa1 soit : -log (6,8 10-5) ; pH= 4,2. pH à l'équivalence : solution d'ascorbate de sodium C6H7O6 - + Na+. [C6H8O6 ] négligeable devant [C6H7O6 -] : [C6H7O6 -] voisin de CaVa /(Va+Vb). solution électriquement neutre : [H3O+] + [Na+] =[HO-]+[C6H7O6 -] [Na+] = CbVb /(Va+Vb) = CaVa /(Va+Vb) ; hypothèse d'un milieu basique [H3O+] négligeable devant [HO-] [Na+] =[HO-]+[C6H7O6 -] conservation du carbone : [C6H7O6 -] + [C6H8O6 ] = CaVa /(Va+Vb) = [Na+] ces deux dernières relations donnent : [C6H8O6 ] =[HO-] = Ke/[H3O+]. or Ka1= [H3O+][C6H7O6 -] / [C6H8O6 ] = [H3O+]2 CaVa /((Va+Vb)Ke) [H3O+]2 =Ka1(Va+Vb)Ke/( CaVa ) = 6,8 10-5*75*10-14 / (0,1*50)= 10-17. [H3O+]=3,2 10-9 ; pH = 8,5. ( l'hypothèse du milieu basique est confirmée) pH de la solution après addition de 26 mL de soude : 1 mL de plus q'à la 1ère équivalence. C6H7O6 - +H2O = C6H6O6 2- + H3O+ ; Ka2 = [C6H6O6 2- ][ H3O+]/[C6H7O6 -] [ H3O+]= Ka2[C6H7O6 -] / [C6H6O6 2- ] C6H7O6 - +HO- = C6H6O6 2- +H2O.
[C6H7O6 -] = 4,8/76 =6,3 10-2 mol/L ; [C6H6O6 2- ] =0,2 / 76 = 2,6 10-3 mol/L [ H3O+]= 2,7 10-12*6,3 10-2 / 2,6 10-3 = 6,5 10-11 mol/L pH= - log 6,5 10-11 =10,2. Exercice
5:
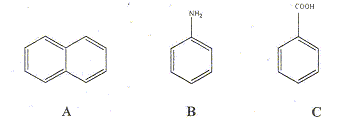
Comment les séparer par extraction liquide liquide ? C conduit à l'ion benzoate en solution aqueuse basique : cet ion est soluble dans la phase aqueuse, insoluble dans la phase organique. B conduit à l'ion anilinium en solution aqueuse acide : cet ion est soluble dans la phase aqueuse, insoluble dans la phase organique.
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|