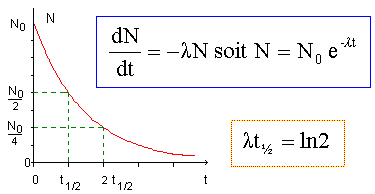|
d'après concours manipulateur électroradiologie médicale APHP 2006. Chute verticale ; datation au carbone 14 ; défibrillateur ; savon ; conductance. |
|||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||
|
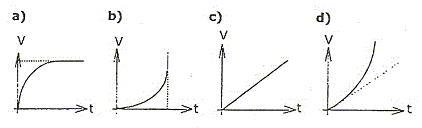
Une goutte d'eau assimilable à une sphère de rayon r, est supposée tomber dans le vide, sans vitesse initiale, à partir d'un point O choisi comme origine d'un axe Ox vertical et orienté vers le haut.
Equation de la réaction nucléaire de formation du carbone 14. 147N + 10n --> 146C + AZX conservation de la charge : 7=6+Z d'où Z= 1 conservation du nombre de nucléons : 14+1 = 14 +A d'où A=1 ; on identifie donc X à H Equation de la réaction nucléaire de désintégration du carbone 14. 614C --> ZAX. + -10e. (la particule b- est un électron) conservation de la charge : 6 = Z-1 soit Z= 7 ( noyau d'azote) conservation du nombre de nucléons : 14 = A+0 soit A=14. temps de demi-vie du carbone 14 : t½ = 5570 ans. Durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. On note N0 le nombre initiaux de noyaux de carbone 14 initiaux et N le nombre de noyaux de carbone 14 présents à la date t. N(t½) = ½N0 ; N(2t½) = 0,25N0 ; N(3t½) = 0,125N0 ; N(4t½) = 0,0625N0 ; N(5t½) = 0,031N0 . Allure de la courbe traduisant l'évolution de N ou encore de l'activité A= lN en fonction du temps :
" Pour obtenir une quinzaine de désintégrations par minute avec un matériau récent, il faut 1 g de carbone, c'est à dire 10 g de bois, de tissu ou de cuir, 20 g de coquillage ou 200 g d'os". Activité A ( Bq) de 200 g d'os d'un être mort récemment : nombre de désintégrations par seconde A= 15/60 = 0,25 Bq. Nombre de noyaux radioactifs présents dans l'échantillon : A= lN avec l = ln2 / t½ = ln2 / (5570*365*24*3600) =3,95 10-12 s-1. N= 0,25 / 3,95 10-12 = 6,3 1010. Rapport N(614C ) / (612C ) dans cet échantillon : dans 1 g de carbone il y a : 1/12 *NA = 1/12*6,02 1023 = 5,0 1022 atomes de carbone 12 N(614C ) / (612C ) = 6,3 1010 / 5,0 1022 = 1,3 10-12.
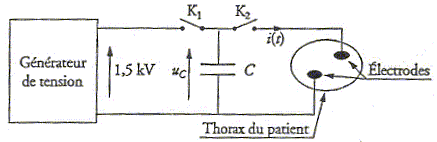
Le défibrillateur cardiaque est un appareil utilisé en médecine d'urgence. Il permet d'appliquer un choc électrique sur le thorax d'un patient, dont les fibres musculaires du coeur se contractent de façon désordonnée ( fibrillation). Il peut être schématisé par :
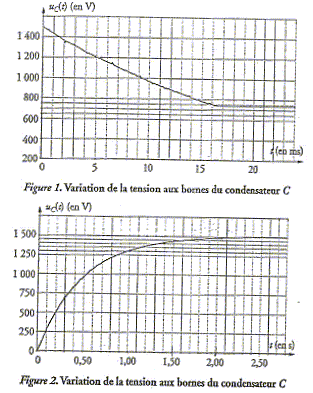
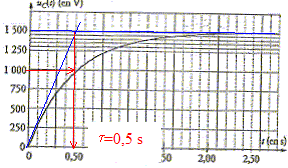
C= 470 mF ; le thorax du patient est assimilé à un conducteur ohmique de résistance R= 50 W. Phase 1 : Lors de la mise en fonction du défibrillateur, le manipulateur obtient la charge du condensateur C, initialement déchargé, en fermant l'interrupteur K1 ( K2 étant ouvert). Parmi les figures suivantes, quelle est celle correspondant à cette phase ? Justifier.
La figure 2 correspond à la charge du condensateur : la tension aux bornes du condensateur est nulle à t=0, puis est croissante ; enfin elle tend vers une valeur égale à la tension aux bornes du générateur. Détermination graphique de la constante de temps :
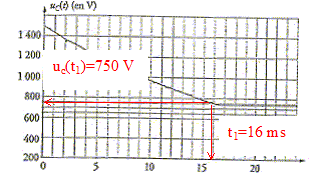
Abscisse de l'intersection de la tangente à l'origine avec l'asymptote horizontale Ou bien, à t = t, la tension aux bornes du condensateur vaut 0,63 fois la valeur maximale soit 1500*0,63 voisin de 1000 V : noter l'abscisse correspondante. Energie maximale stockée par le condensateur : W = ½C U2max. W= 0,5 * 4,7 10-4 * 15002 = 529 J. phase 2 : Dès que le condensateur est chargé, le manipulateur peut envoyer le choc électrique en connectant le condensateur aux électrodes posées sur le thorax du patient. Il choisit alors le niveau d'énergie du choc électrique qui sera administré au patient, par exemple 400 J. A la date initiale t=0, le manipulateur ferme l'interrupteur K2 ( K1 ouvert) ce qui provoque la décharge partielle du condensateur ; la décharge est automatiquement arrêtée dès que l'énergie choisie a été délivrée. Au cours de l'application du choc électriqu, la tension aux bornes du condensateur varie suivant uc(t) = A exp(-t/(RC)). A est la tension maximale aux bornes du condensateur chargé : A = 1500 V. La constante de temps vaut RC= 50*4,7 10-4 =2,35 10-2 s. Relation liant l'intensité du courant i(t) et la charge électrique q(t) de l'armature positive du condensateur : i(t) = - dq/dt. Relation entre la tension uc(t) et la charge électrique q(t) : q(t) = Cuc(t). Expression de i(t) : i(t) = - dq/dt = - Cduc(t) /dt = -C(-1/(RC) A exp(-t/(RC)) i(t) = A/Rexp(-t/(RC)) ; de la forme i(t) = Bexp(-t/(RC)) avec B= A/R = 1500/50 = 30 A, valeur indépendante de C. L'intensité est maximale à l'instant t=0. phase 3 : La décharge cesse dès que l'énergie W=400 J a été délivrée. En utilisant l'une des figures ci-dessus, donner la date t1 à laquelle la décharge partielle du condensateur a été arrêtée.
En s'appuyant sur la variation de l'énergie du condensateur entre les dates t=0 et t1, on peut retrouver uc(t1) W(t=0 ) = 529 J ; Wt1 = ½Cu2c(t1) ; W(t=0 ) -Wt1 = 400 J 529- ½Cu2c(t1) =400 ; ½Cu2c(t1) = 129 ; u2c(t1)
= 2*129/4,7 10-4 = 5,49 105 ;
uc(t1) = 741 V.
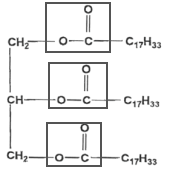
On trouve dans le commerce des savons fabriqués à partir d'huile d'olive. Ils sont obtenus en faisant réagir de la soude avec l'huile d'olive dans certaines conditions. On peut considérée que l'oléine, triester du glycérol CH2OH-CHOH-CH2OH et de l'acide oléique (C17H33-COOH) est le seul corps gras présent dans cette huile. La molécule d'oléine, écrite ci-dessous compte trois fonctions ester.
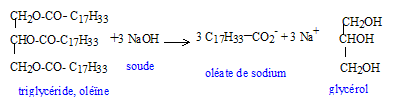
Equation de la réaction modélisant la transformation ( saponification)
On chauffe pendant 30 min un mélange de 0,10 mol d'oléine et de 0,50 mol de soude, 2 mL d'éthanol et quelques grains de pierre ponce. Tableau d'avancement
: si la soude est en défaut : 0,5-3xmax = 0 soit xmax =0,17 mol Quantité de matière de savon : 0,3 mol ; m(savon) = 304 g/mol ; masse de savon = nM= 0,3*304 = 91 g. On représente l'ion oléate sous la forme suivante : ---------------O : La partie hydrophile est -COO- représentée par O ; la partie hydrophobe est la longue chaine carbonée représentée par ------------ Equation entre l'ion carboxylate et l'eau : couples acide base : RCOOH / R-COO- et H2O/HO- : R-COO- + H2O
= RCOOH + HO- ( présence majoritaire des
bases R-COO- et de HO- en solution ;
le pH d'une eau savonneuse est donc supérieure
à 7 ).
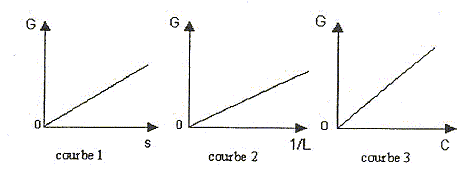
Une étude de l'évolution de la conductance G d'une solution ionique diluée en fonction des facteurs s, L, c dans les mêmes conditions de température et de pression, donne les courbes suivantes :
Que représentent C, s, L et G ? Indiquer les unités : C : concentration de la solution en mol m-3. s : surface (m2) des deux plaques parallèles constituant la sonde de mesure. L : distance (m) de ces deux plaques. G : conductance ( siemens (S)) de la portion de solution comprise entre les deux plaques. D'après ces courbes G est proportionnelle à C, s et 1/L : G=L sC/L avec L une constante. L = GL/(sC) ; L s'exprime en S m /(m2 mol m-3) soit en S m 2 mol-1 ; L est une conductivité molaire ionique. On relève les conductances
obtenues dans des conditions expérimentales
identiques, de solutions ioniques de concentration : KOH : conductivité s1 =( lK+ +lOH- ) C ; conductance G1 = ks1 = k( lK+ +lOH- ) C (1) avec k une constante. NaOH : conductivité s2 =( lNa+ +lOH- ) C ; conductance G2 = ks2 = k( lNa+ +lOH- ) C (2) NaNO3 : conductivité s3 =( lNa+ +lNO3- ) C ; conductance G3 = ks3 = k( lNa+ +lNO3- ) C (3) KNO3 : conductivité s4 =( lK+ +lNO3- ) C ; conductance G4 = ks4 = k( lK+ +lNO3- ) C (4) (4) = (1) - (2) +(3) ; G4 = G1- G2 + G3 =(2,78-2,54+1,25) 10-3 =1,49 10-3 S. |
|||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||
|
|