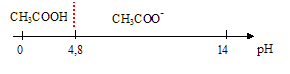|
Concours
ca/plp
: étude de
solutions acides ; degré d'acidité d'un
vinaigre
2007
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
Données à 298 K : acide éthanoïque / base conjuguée : pKa = 4,8 ; pKe = 10-14 ; M( acide éthanoïque) = 60,1 g/mol. I. Etude de solutions acides : Les pH de solutions d'acide chlorhydrique et d'acide éthanoïque de même concentration c=0,0100 mol/L valent respectivement 2,0 et 3,4.
On admettra que la concentration d'une espèce X est négligeable devant celle d'une espèce Y si [X] <=[Y]/10. Le but de cette partie est de déterminer le degré d'cidité d'un vinaigre, c'est à dire la masse d'acide éthanoïque exprimée en gramme, présente dans 100 g de vinaigre. On admet que le seul acide présent dans le vinaigre est l'acide éthanoïque et que la densité du vinaigre vaut 1,00 à 298 K. Le vinaigre est dilué 10 fois pour préparer 100,0 ml d'une solution S de vinaigre dilué. Le mode opératoire suivant est proposé pour doser l'acide éthanoïque dans le vinaigre : - Introduire dans un becher de 100 mL, V1 = 20,0 mL de la solution S. - Ajouter 20 mL d'eau distillée. - Placer dans la solution la sonde du pHmètre. - Doser à l'aide d'une solution d'hydroxyde de sodium de concentration molaire volumique c= 0,100 mol/L. La valeur du volume équivalent Ve = 19,80 mL est alors déterminée graphiquement.
Les pH de solutions d'acide chlorhydrique et d'acide éthanoïque de même concentration c=0,0100 mol/L valent respectivement 2,0 et 3,4. Le nom usuel de l'acide éthanoïque est acide acétique. La fonction organique présente dans l'acide éthanoïque est " acide carboxylique -COOH". Equation associée à la dissociation de l'acide éthanoïque dans l'eau : CH3-COOH + H2O = CH3-COO- + H3O+. (1) La base conjuguée de l'acide éthanoïque se nomme : ion éthanoate ( acétate). Coefficient de dissociation a de l'acide éthanoïque : a = [CH3-COO-]/c ; la solution étant électriquement neutre [CH3-COO-] = [H3O+] a = [H3O+] /c = 10-pH/c = 10-3,4 / 10-2 = 10-1,4 =3,98 10-2. ( 4,0 10-2) Retrouvon à partir de a et du pH de la solution de concentration c, la valeur du pKa du couple acide éthanoïque/ion éthanoate. La constante d'équilibre relative à (1) s'écrit : Ka = [H3O+][CH3-COO-] / [CH3-COOH] avec [H3O+] =[CH3-COO-]=a c ; conservation de l'élément carbone : [CH3-COO-] + [CH3-COOH] = c [CH3-COOH] = c-[CH3-COO-] = c(1-a) Ka =(a c)2 / (c(1-a)) = a2 c / (1-a). Ka = (3,98 10-2)2 *0,01/(1-0,04) = 1,65 10-5 ; pKa = -log(Ka) = -log(1,65 10-5) =4,78. (4,8). L'acide éthanoïque est peu dissocié ( 4 %) et de l'acide chlorhydrique est entièrement dissocié ( a= 1). A concentration égale, l'acide chlorhydrique est plus fort que l'acide éthanoïque. Diagramme de prédominance relatif à l'acide éthanoïque et à sa base conjuguée.
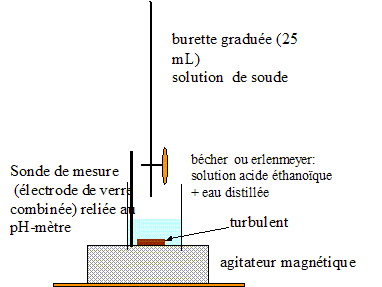
II. Dosage de l'acide éthanoïque dans du vinaigre : Protocole opératoire pour réaliser la dilution. Le vinaigre est dilué 10 fois pour préparer 100,0 ml d'une solution S de vinaigre dilué. Prélever 10,0 mL de vinaigre à l'aide d'une pipette jaugée + pipeteur. Placer dans une fiole jaugée de 100,0 mL et compléter avec de l'eau distillée jusqu'au trait de jauge. Boucher et agiter pour rendre homogène. Schéma annoté du montage utilisé pour réaliser ce dosage :
Equation de la réaction de dosage : HO- + CH3COOH = H2O + CH3COO-. K= [CH3COO-]/([CH3COOH][HO-]). Or CH3COOH + H2O = CH3COO- + H3O+ ; Ka = [CH3COO-][ H3O+] / [CH3COOH] soit [CH3COO-]/[CH3COOH] = Ka/[ H3O+] repport dans K ; K = Ka/([ H3O+][HO-]) = Ka/Ke = 10-4,8 / 10-14 ; K = 109,2. La valeur de cette constante est très grande, la réaction est totale. Concentration c1 en acide éthanïque de la solution S : A l'équivalence V1 c1 = Vé c ; c1 = Vé c / V1 = 19,8*0,1 / 20 ; c1 = 9,90 10-2 mol/L. Concentration c0 du vinaigre en acide éthanoïque : c0 = 10 c1 ; c0 = 9,90 10-1 mol/L. Valeur du degré d'acidité du vinaigre : masse d'acide éthanïque dans 1 L de vinaigre : c0M = 0,99*60,1 = 59,5 g degré = masse d'acide éthanoïque dans 100 mL ( ou 100 g) de vinaigre : 5,95 °.
Valeur du pH initial avant tout ajout d'hydroxyde de sodium : CH3COOH + H2O = CH3COO- + H3O+ ; Ka = [CH3COO-][ H3O+] / [CH3COOH] La solution est électriquement neutre : [CH3COO-]=[ H3O+] ; en milieu acide [HO-] est négligeable. Conservation de l'élément carbone : [CH3COO-] + [CH3COOH] = c1V1/(V1+20)= ½c1. L'acide étant peu dissocié alors [CH3COOH] voisin de ½c1. par suite Ka = [ H3O+]2 / (½c1) ; [ H3O+] = [Ka ½c1]½ =[10-4,8*0,5*9,9 10-2]½=8,86 10-4 ; pH initial = 3,05. Espèces chimiques majoritaires présentes à l'équivalence : H2O ; Na+ ; CH3COO- ; HO-. Solution électriquement neutre : [CH3COO-] +[HO-] =[Na+ ] =cVe/Vtotal. Conservation de l'élément carbone : [CH3COO-] + [CH3COOH] = c1V1/Vtotal = cVe/Vtotal. Par suite : [CH3COOH] = [HO-] Réaction prépondérante : CH3COO- + H2O = CH3COOH +HO- (2) ; K = [HO-][CH3COOH]/[CH3COO-]=[HO-]2/[CH3COO-] or [CH3COOH]/[CH3COO-] = [ H3O+] /Ka ; K = [HO-][ H3O+] /Ka = Ke/Ka = 10-9,2 = 6,3 10-10. en conséquence (2) est très limitée et [CH3COO-] voisin c1V1/Vtotal =0,099*20/(20+20+19,8)=3,3 10-2. [HO-]2 = K[CH3COO-] = 6,3 10-10*3,3 10-2 =2,1 10-11 ; [HO-] = 4,6 10-6 ; [ H3O+] =2,2 10-9 ; pH =8,6. La valeur du pH à l'équivalence est supérieure à 7. Valeur du pH à la demi équivalence : [CH3COO-] = [CH3COOH] et pH= pKa = 4,8. Valeur du pH de la solution pour un volume versé V2 = 25,00 mL d'hydroxyde de sodium :
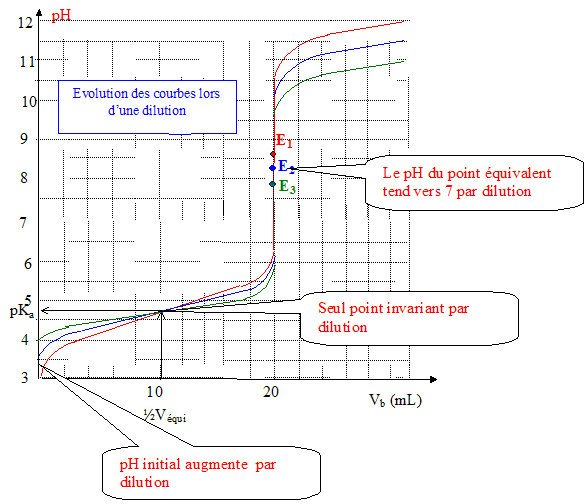
Solution électriquement neutre : [CH3COO-] +[HO-] =[Na+ ] =cV2/Vtotal. [HO-] =cV2/Vtotal - [CH3COO-] =cV2/Vtotal -cVe/Vtotal ; [HO-] = c/Vtotal(V2-Ve). [HO-] = 0,1*(25-19,8) / (20+20+25)=8 10-3 mol/L ; [ H3O+] = 10-14 /8 10-3 =1,25 10-12 mol/L ; pH =11,9. Allure de la courbe de dosage pH-métrique obtenue :
Deux méthodes permettant de repérer l'équivalence sur une courbe : méthode des tangentes ; la courbe dérivée présente un maximum à l'équivalence. On ajoute de l'eau distillée afin que l'extrémité de la sonde du pHmètre soit correctement immergée. Il n'est pas nécessaire de connaître avec précision la quantité d'eau introduite pour réaliser ce dosage : l'eau n'apporte pratiquement aucun ion oxonium et hydroxyde et à l'équivalence V1 c1 = Vé c ; dans cette relation le volume total de la solution n'intervient pas. |
|||||||||||||||||||||||
|
|
|||||||||||||||||||||||
|
|