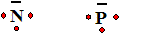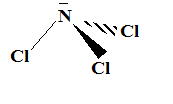|
Concours
Capes
interne
: chimie du phosphore
; dosage de l'acide orthophorique ; solubilité des
ions phosphate
2007
|
|||
|
|||
|
Données : masse molaire (g/mol) : H : 1,0 ; O : 16,0 ; P : 31,0 ; K : 39,1. Valeurs de pKa des trois couples de l'acide phosphorique : 2,1 ; 7,2 ; 12,4. pKs(Ca3(PO4)2 = 26,0 ; pKs (CaHPO4) = 7,0. I. Etude structurale :
L'acide phosphorique est un additif utilisé pour acidifier certaines oissons. Son nom de code est E338. La valeur limite de 0,6 g/L ne peut pas être dépassée. Protocol expérimental : préparation de la boisson : Pour être sûr de doser l'acide phosphorique
et non le dioxyde de carbone introduit sous pression en
grande quantité dans les boissons gazeuses, il faut
au préalable éliminer ce dernier. On utilise
pour cela le fait que sa solubilité diminue quand la
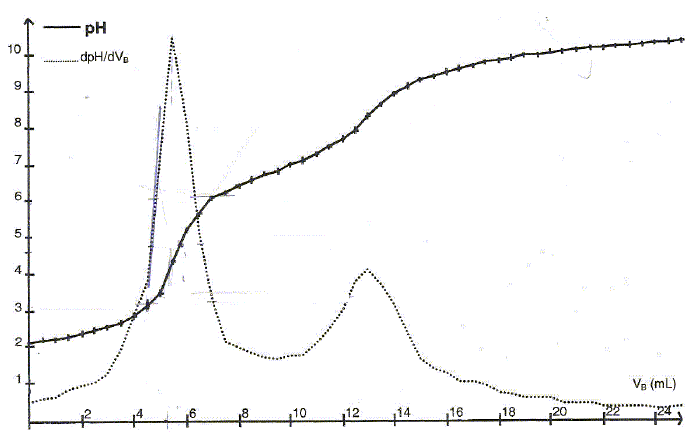
température augmente. - Laisser ensuite le liquide refroidir à l'air puis passer le ballon sous l'eau du robinet. Dosage de l'acide phosphorique dans la boisson : - On dose un volume V= 25,0 mL de boisson décarboniquée par de la soude de concentration cB= 2,0 10-2 mol/L. - On trace la courbe de variation du pH en fonction du
volume vB de soude versé puis la courbe
dérivée dpH/dvB. Seules les deux
premières acidités de l'acide phosphorique
sont dosées.
Le phosphore est un élément vital pour les plantes et il est donc présent dans de nombreux engrais. La fluoroapatite, minerai naturel peut être considéré comme un complexe de phosphate tricalcite Ca3(PO4)2 et de fluorure de calcium.
N : 1s2 2s2 2 p3
; P : 1s2 2s2 2 p6
3s2 3 p3.
Géométrie de la molécule de trichlorure d'azote : pyramide à base triangulaire.
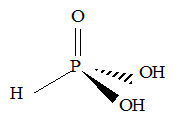
Représentation de Lewis de l'acide phosphoreux H3PO3 :
Il s'agit d'un diacide. L'hydrogène lié au
phospore n'est pas ionisable. Le phosphore, en tant que corps pur, existe sous
plusieurs formes allotropiques. Le terme
"allotropique"signifie qu'à la même
température, le corps pur existe sous
différentes formes cristallines ou
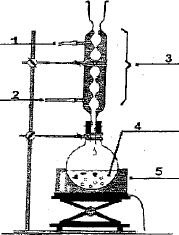
moléculaires différentes. II. Dosage de l'acide orthophorique dans une boisson : Schéma du montage à
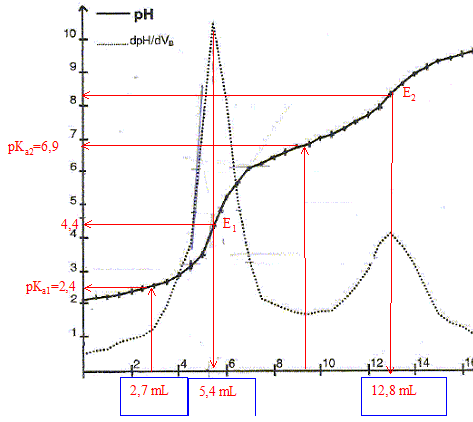
reflux : 2 : entrée de l'eau. 3 : réfrigérant droit 4 : ballon + boisson 5 : chauffe ballon Rôle du montage à reflux : en travaillant à température modérée on augmente la vitesse de la réaction tout en évitant les pertes de matière ( les vapeurs qui se dégagent se condensent dans le réfrigérant et retombent dans le ballon. Equations des réactions correspondant à ces deux dosages : HO- + H3PO4 = H2O + H2PO4-. HO- + H2PO4-= H2O + HPO42-. On peut retrouver sur la courbe de dosage les valeurs des pKa des couples de l'acide phosphorique : ces valeurs sont en accord ( à 10 % près) avec les valeurs théoriques.
En travaillant sur la première équivalence E1, calcul de la concentration cA de l'acide phosphorique. à la première équivalence : CaV = CB Véq1 ; Ca=CB Véq1/V Ca=2,0 10-2 *5,4/25 =4,3 10-3 mol/L. masse molaire H3PO4 : M = 3+31+64 = 98 g/mol. masse d'acide phosphorique par litre de boisson : 98*4,3 10-3 = 0,42 g/L. La boisson correspond donc à la norme. On peut doser la seconde acidité de l'acide phosphorique en utilisant la phénolphtaléine comme indicateur coloré : la zone de virage de la phénolphtaléine est 8,2 ; 10,0 ; elle contient le pH du second point équivalent. Dosage des ions
hydrogénophosphate. HPO42-+HO- =
PO43-+H2O. K = [PO43-] /([HO-][HPO42-] ) Or HPO42-+H2O = H3O+ +PO43- Ka3 = [H3O+][PO43-] / [HPO42-] ; [PO43-] / [HPO42-] = Ka3 / [H3O+] repport dans l'expression de K : K=
Ka3 /
([H3O+][HO-])
=Ka3 /Ke = 10-12,4 /
10-14 = 101,6 =
39,8.
III. Solubilité des ions phosphate : Le phosphore est un élément vital pour les plantes et il est donc présent dans de nombreux engrais. La fluoroapatite, minerai naturel peut être considéré comme un complexe de phosphate tricalcite Ca3(PO4)2 et de fluorure de calcium. Solubilité s du phosphate tricalcique : pKs(Ca3(PO4)2 = 26,0 ; pKs (CaHPO4) = 7,0. Ca3(PO4)2 (s) = 3 Ca2+(aq) + 2PO43-(aq) ; On pose s = [Ca3(PO4)2 ]dissous = [Ca2+]/3 ; [Ca2+] = 3 s. la solution est électriquement neutre 3 [PO43-]= 2[Ca2+] ; [PO43-]=2s. Ks = [Ca2+]3 [PO43-]2=27s3*(2s)2 = 108 s5. s = [Ks/108]1/5 = [ 10-26/108]1/5 =2,5 10-6 mol/L On ne peut pas répandre du minerai broyé pour fertiliser son jardin car la solubilité du phosphate tricalcique est trop faible : le phosphore ne pourait pas être assimilé par les plantes. Solubilité s' de l'hydrogénophosphate de calcium : CaHPO4(s) = Ca2+(aq) + HPO42-(aq) ; on pose [Ca2+]=s' K's = [Ca2+] [HPO42-]=s'2. s' = K's ½ =(10-7) ½ =3,2 10-4 mol/L. Le pH a une influence sur la solubilité du phospate de calcium car l'ion HPO42- joue le rôle de base dans le couple acide base H2PO4- /HPO42- et d'acide dans le couple acide base HPO42- /PO43- . L'action de l'acide sulfurique sur les apatites naturelles broyées ( phosphate tricalcique) conduit à un mélange de dihydrogénophosphate de calcium et de sulfate de calcium, appelé superphosphate simple et utilisé comme engrais. Equation de la préparation d'un superphosphate simple : Ca3(PO4)2 + 2H2SO4 = 2CaSO4 + Ca(H2PO4)2. |
|||
|
|
|||
|
|