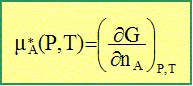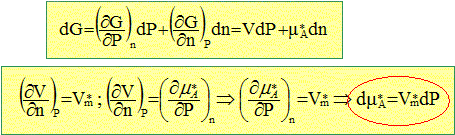|
Montée de la sève dans les arbres ; pression osmotique concours agrégation 2007 |
||||
|
||||
|
On s'intéresse ici à la montée de la sève dans les arbres. Pression osmotique. On considère un récipient formé de deux compartiments, gauche et droite, de même volume V et de même température T, séparés par une membrane semi-perméable, c'est à dire perméable au solvant A mais imperméable à un soluté B. Le compartiment de gauche contient une solution supposée idéale du soluté B dans A, celui de droite le solvant pur sous la pression P. Rappeler la définition du potentiel chimique mA*(P,T) du corps pur A à la pression P et à la température T. On note G(P,T, nA) la fonction d'état enthalpie libre associée à A, corps pur.
A partir de l'expression de la variation d'enthalpie libre dG, exprimer la variation dmA* du potentiel chimique du corps pur A en fonction du volume molaire Vm* de A et de la variation de pression dP qui en est la cause à température T fixée. dG= V dP-SdT+mA*dnA A température constante le terme SdT est nul : dG= V dP+mA*dnA. On note n= nA.
On supposera par la suite que Vm* ne dépend pas de la pression. Donner l'expression du potentiel chimique du solvant A dans chaque compartiment. Compartiment de droite : le solvant est pur : mA droite = m A*(P,T). Compartiment de gauche : on note xA la fraction molaire de A et P' la pression dans ce compartiment : mA gauche = m A*(P',T) + RT ln xA. Le système est à l'équilibre. Ecrire la condition d'équilibre que doit vérifier le solvant. mA droite =mA gauche m A*(P,T) = m A*(P',T) + RT ln xA. m A*(P',T) -m A*(P,T) = -RT ln xA. m A*(P',T) -m A*(P,T) = dm A* = Vm*dP = Vm*(P'-P) On note p= P'-P p= -RT / V*m ln xA. Or xA<1 donc ln xA<0 et -RT ln xA>0 donc pest positif. Il existe une surpression p ( pression osmotique) dans le compartiment de gauche.
Montrer que la pression osmotique est de la forme p=nBRT/ V où nB est la quantité de matière du soluté B. xA+ xB = 1 soit - ln xA =- ln(1-xB) Si xB <<1 alors - ln(1-xB) voisin de xB. d'où p = RT / V*mxB. xB = nB/(nA+nB) En solution diluée ( nB<<nA), xB voisin de nB/nA. d'où p = RT nB /(nAV*m). En solution diluée nAV*m voisin Vdroite voisin Vgauche = V. Par suite : p = RT nB /V.
A.N : cas de la sève d'érable. On prendra T= 290 K; masse volumique de la sève : rsève = 103 kg m-3. La concentration du sucre dans une sève normale , assimilée à une solution aqueuse, est environ C=10 g/L. Calculer la pression osmotique de la sève par rapport à l'eau du sol autour des racines. nB/V =C/M avec M : masse molaire du saccharose C12H22O11. M = 12*12+22+16*11 = 342 g/mol. nB/V = 10/342 = 2,92 10-2 mol/L = 29,2 mol m-3. p = RT nB /V. p = 8,32*290* 29,2 = 7,05 104 Pa = 0,70 bar.
p = rsève g h. h = p / ( rsève g) = 7,05 104 / (103*9,8) =7,2 m. La pression osmotique peut-elle expliquer la montée de la sève dans les grands arbres ( hauteur supérieure à 20 m) ? Non, c'est l'évapotranspiration au niveau des feuilles. Sous l'action de la chaleur solaire, les feuilles transpirent : l'eau contenue dans les feuilles s'évapore. Cette évaporation entraîne une dépression dans les canaux qui transportent la sève : il en résulte un effet de succion dans les racines.
|
||||
|
|
||||
|
|