|
Protection électrochimique d'une cuve enfouie dans le sol BTS travaux publics 2007 ( 6 points) |
|||
|
|||
|
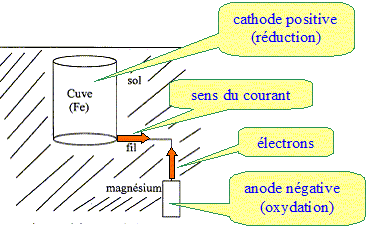
Données : potentiel standard des couples redox E°(Fe2+ / Fe) = -0,44 V ; E°(Mg2+ / Mg) = -2,37 V Masse molaire ( g/mol) Fe : 55,8 ; Mg : 24,3 ; 1 F = 9,65 104 C Ecrire et équilibrer les demi-équations électroniques qui se produisent sur l'électrode de magnésium et sur la cuve. Indiquer l'oxydation et la réduction. Oxydation du magnésium : Mg = Mg2+ + 2e-. Réduction des ions Fe2+ ( au niveau de la cuve) : Fe2++ 2e- = Fe.
Explique pourquoi le magnésium est capable de protéger le fer. Le magnésium est un métal plus réducteur que le fer : E°(Mg2+ / Mg) <E°(Fe2+ / Fe) Le magnésium s'oxyde
à la place du fer ; ce dernier est donc
protégé tant qu'il y a du magnésium.
Calculer la durée Dt de cette protection, exprimée en secondes puis en années. Quantité de matière (mol) de magnésium = masse (g) / masse molaire (g/mol) n(Mg) = m/M= 200 / 24,3 = 8,23 mol Or Mg = Mg2+ + 2e-. donc la quantité de matière d'électrons est égale à : n(e-) = 2 n(Mg) = 16,5 mol ( 16,460) La quantité d'électricité traznsportée par une mole d'électrons est : 96500 C Quantité d'électricité Q = 96500 * n(e-) = 96500*16,46 = 1,59 106 C ( 1,5885 106) Quantité d'électricité Q = IDt avec I= 0,015 A Dt = 1,5885 106 / 15 = 1,06 108 s soit 3,36 ans.
Quelle serait la masse de fer qui disparaîtrait pendant la même durée, dans les mêmes conditions si la cuve n'était pas protégée ? n(Fe) = n(Mg) = 8,23 mol masse (g) = masse molaire du fer (g/mol) * quantité de matière (mol) m(fer) = 55,8*8,23 = 459 g. |
|||
|
|
|||
|
|