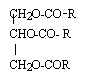|
Bts esthétique 2001 : acide lactique, triglycérides, électricité |
|||
|
|||
L'huile de ricin est un corps gras utilisé en cosmétologie. Elle est constituée essentiellement de triricinoléate de glycéryle, de masse molaire M= 932 g/mol, molécule insaturée désignée par A.
corrigé Masse molaire acide lactique C3H6O3 : M =3*12+6+3*16 =90 g/mol. Quantité de matière (mol) = masse (g) / masse molaire (g/mol) : n = m/M = 18/90 =2,0 10-1 mol. concentration (mol/L) = quantité de matière (mol) / volume de la solution (L) = n/V = 0,2 / 0,25 =8,0 10-1 mol/L. Equation bilan de la réaction de l'acide lactique avec l'eau : CH3-CHOH-COOH + H2O = CH3-CHOH-COO- + H3O+. constante d'équilibre ou constante d'acidité du couple acide base CH3-CHOH-COOH /CH3-CHOH-COO- Ka =[ H3O+][CH3-CHOH-COO-] / [CH3-CHOH-COOH] ; pKa = - log Ka c : concentration de l'acide lactique ; pH = - log [ H3O+] avec [ H3O+] exprimée en mol/L Conditions de validité de la relation pH= ½( pKa + log c) : solution pas trop concentrée afin de confondre activité et concentration ; l'acide doit être peu dissocié afin que CH3-CHOH-COO- soit négligeable devant [CH3-CHOH-COOH] pH = 0,5(3,9 + log 8 10-1) =1,9. d'où [ H3O+]=[CH3-CHOH-COO-]= 10-1,9=1,25 10-2 mol/L et [CH3-CHOH-COOH] = 0,8-0,0125 =0,787 mol/L La relation pH= ½(
pKa + log c) était donc bien appliquable.
Une solution tampon permet de maintenir le pH constant par suite d'une dilution modérée. Pour obtenir une lotion de pH égal à 3,9 à partir d'une solution d'acide lactique de concentration 0,01 mol/L, il faut ajouter de la soude jusqu'à ce que : [CH3-CHOH-COO-]
=[CH3-CHOH-COOH] =0,01/2 = 0,005 mol/L
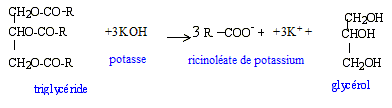
Equation bilan de la saponification d'un triglycéride avec une solution d'hydroxyde de potassium :
Masse d'hydroxyde de potassium nécessaire à l'obtention de 10 g de ricinoléate de potassium : La masse molaire du triglycéride est égale à : 3 masse molaire de R + ( 6*12+5+6*16) M = 3MR + 173 = 932 doù MR= (932-173) / 3 = 253 g/mol M (RCOOK) = 253+12+32+39=336 g/mol n(RCOOK) = m/M = 10/336 = 2,98 10-2 mol d'après les coefficients de l'équation ci-dessus : n( potasse) = n(RCOOK) m(potasse) = 2,98 10-2
*(39+16+1) =1,67 g.
L'hydrogénation catalytique de A donne une chaîne carbonée saturée. Le produit, corps gras saturé, est un solide. L'indice d'iode d'un corps gras A est la masse de diiode (I2), exprimée en grammes, que peut fixer 100 g de A. Relation entre les quantités de matière de diiode et A : n( triglycéride) = 100 / 932 = 0,107 mol. n(I2) = 82/(2*127) = 0,323 mol d'où n(I2) = 3 n( triglycéride). La molécule A compte 3
liaisons doubles C=C.
On admettra que les lois du courant continu s'appliquent.
corrigé Intensité du courant : P= UI soit I= P/U = 550/220 = 2,5 A. Force contre électromotrice du moteur : U = E+rI soit E=U-rI = 220-2*2,5 = 215 V. Puissance dissipée par effet Joule dans le bobinage du moteur : PJ= rI2 = 2*2,52 = 12,5 W Quantité de chaleur dissipée dans le bobinage au bout de 7 min de fonctionnement : Q= PJDt
= 12,5*7*60 = 5,25 kJ.
Puissance dissipée par effet Joule dans le moteur : rI2 = 2*110*110 = 24 kW. L interrupteur de protection contre les surintensités, intégré au circuit électrique de l'appareil coupe l'alimentation du moteur ; sinion le moteur serait grillé. |
|||
|
Un appareil à cire est constitué d'une cuve en aluminium de masse 0,25 kg chauffé par une résistance thermo-régulée.La puissance électrique de cet appareil est 200 W. La cuve contient 500 g de cire, ressolidifiée après fusion et épousant la forme de la cuve. L'ensemble est à la température ambiante de 18°C. Cette cire dite "tiède" commence à fondre à 37°C. Le début de la fusion est observé au bout de 2 min 10 s.
corrigé Capacité thermique massique, notée c, de la cire solide : énergie électrique reçue en Dt =2 min 10 s = 130 s : Q1= P Dt =200*130 = 2,6 104 J énergie reçue par la cire : Q= m c Dq =0,5 c* (37-18) = 9,5 c énergie reçue par l'aluminium : Q' = m Al cAl Dq = 0,25*895*(37-18) =4,25 103 J Q1 = Q+Q' ; 2,6 104 = 9,5 c + 4,25 103 ; c = ( 2,6 104-4,25 103)/ 9,5 = 2289 J kg-1 K-1. Cette cire n'étant pas un corps pur, sa température de fusion n'est pas constante. Quantité de chaleur nécessaire à cette seconde étape : P Dt = 200*12*60 = 1,44 105 J Quantité de chaleur nécessaire à la fusion de 1 kg de cette cire : 2*1,44 105 = 2,88 105 J kg-1.
|
|||
|
|