|
bac S Amérique Nord 2007: Détermination de la concentration en dioxyde de soufre de l'air dans une grande agglomération
|
|||
|
|||
|
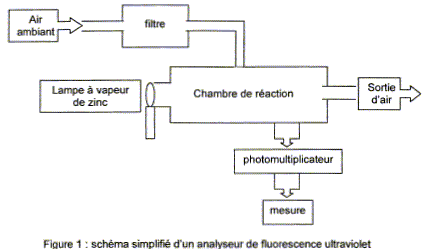
On se propose d'étudier dans cet exercice une des méthodes permettant de déterminer la concentration en dioxyde de soufre dans l'air : la fluorescence ultraviolet (UV). Principe de la méthode Dans l'air ambiant, les molécules de dioxyde de soufre SO2 sont dans un état d'énergie " fondamental " stable E0. L'air ambiant est aspiré par un analyseur, filtré pour éliminer les éléments " parasites " pour la mesure, puis envoyé dans une chambre de réaction dans laquelle il est soumis à un rayonnement ultraviolet dont la longueur d'onde est l1 = 214 nm et provenant d'une lampe à vapeur de zinc. Les molécules de dioxyde de soufre de l'air sont ainsi portées dans un état d'énergie E1. Cet état étant instable, le dioxyde de soufre de l'air se désexcite alors très rapidement et arrive dans un état d'énergie E2 différent de E0 en émettant un rayonnement UV de longueur d'onde l2 supérieure à celle du rayonnement d'excitation. Le rayonnement UV est reçu par un photomultiplicateur qui donne alors une tension de sortie US proportionnelle à la concentration en dioxyde de soufre présent dans la chambre de réaction.
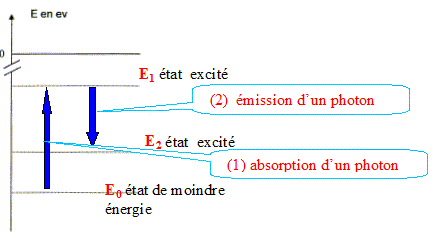
h = 6,63 10-34 J.s ; c = 3,0 108 m/s ; 1 eV = 1,6 10-19 J ; 1 ppbv (partie par milliard en volume) = 2,66 µg.m-3 pour le dioxyde de soufre. Étude du diagramme simplifié des niveaux d'énergie. Comment appelle-t-on l'état d'énergie E1 de la molécule de dioxyde de soufre ? En vous aidant du texte, placer sur le diagramme en annexe, à rendre avec la copie, les états d'énergie E0, E1 et E2, en justifiant la démarche. Étude de la transition entre les états d'énergie E0 et E1. Cette transition correspond-elle à une émission ou une absorption de lumière ? Justifier. Représenter sur le diagramme cette transition par une flèche notée 1. Donner l'expression littérale de l'énergie DE1 correspondant à la transition en fonction des données. La calculer en eV. Etude de la transition entre les états d'énergie E1 et E2. Au cours de cette transition les molécules échangent avec l'extérieur une quantité d'énergie DE2 = 3,65 eV. Représenter sur le diagramme cette transition par une flèche notée 2. Déterminer, en nm, la longueur d'onde de la radiation émise l2. Cette radiation est-elle bien dans le domaine de l'ultraviolet ? Justifier.
L'état d'énergie E1 de la molécule de dioxyde de soufre est un état excité. Les états d'énergie E0, E1 et E2 : E0 correspond à un niveau de moindre énergie. E1 est un état excité d'énergie supérieur à E0 : la molécule a gagné l'énergie hc/l1. Puis la molécule se désexcite et cède l'énergie hc/l2. Or la longueur d'onde l2 supérieure à celle du rayonnement d'excitation : donc hc/l2 < hc/l1. Étude de la transition entre les états d'énergie E0 et E1.
Energie DE1 correspondant à la transition : DE1 = E1-E0 = hc/l1 DE1 = 6,63 10-34 *3,0 108 /214 10-9 = 9,29 10-19 J 9,29 10-19 /1,6 10-19 = 5,81 eV. Etude de la transition entre les états d'énergie E1 et E2. Au cours de cette transition les molécules échangent avec l'extérieur une quantité d'énergie DE2 = 3,65 eV. DE2 = 3,65 *1,6 10-19 = 5,84 10-19 J DE2 = hc/l2 ; l2 =DE2/ ( hc) l2 =6,63 10-34 *3,0 108 /5,84 10-19=3,41 10-7 m = 341 nm Cette radiation est bien dans le domaine de l'ultraviolet : 341 nm est inférieure à 400 nm, limite entre l'UV et le visible.
Concentration [SO2]1 en dioxyde de soufre pour l'air de la grande agglomération en ppbv. "un photomultiplicateur qui donne alors une tension de sortie US proportionnelle à la concentration en dioxyde de soufre présent dans la chambre de réaction." [SO2]1 = 100*0,15 / 0,5 = 30 ppbv. Or 1 ppbv (partie par milliard en volume) = 2,66 µg.m-3 pour le dioxyde de soufre. [SO2]1 =30*2,66 = 80 µg.m-3 La limite admise pour une personne étant de 50 µg.m-3 de gaz, l'air de la grande agglomération n'est pas respirable sans danger.
|
|||
|
|
|||
|
|