|
bac S Amérique Nord 2007 : acide base : teneur en élément azote d'un engrais. ( 6,5 points)
|
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
L'ammonitrate est un engrais azoté solide, bon marché, très utilisé dans l'agriculture. Il contient du nitrate d'ammonium NH4NO3(s). Sur le sac on peut lire " pourcentage massique en élément azote N 34,4 %". Afin de vérifier l'indication du fabricant, on dose les ions ammonium NH4+ présents dans l'engrais à l'aide d'une solution de'hydroxyde de sodium Na+(aq) + HO-(aq). Couples acide /base : NH4+ (aq) /NH3(aq) ; H2O (l) / HO-(aq). N : 14 ; H : 1 ; O : 16 g/mol. Le nitrate d'ammonium est très soluble dans l'eau, sa dissolution dans l'eau est totale selon la réaction : NH4NO3(s) = NH4+ (aq) + NO3- (aq). Etude de la réaction de titrage : l'équation support du titrage est : NH4+ (aq) +HO-(aq) = NH3(aq) + H2O (l)
L'ion ammonium NH4+ (aq) est un acide selon Brönsted : cet ion est susceptible de libérer un proton H+ selon : NH4+ (aq) = NH3(aq) + H+ Tableau d'avancement
: quantité de matière (mol) = concentration (mol/L)*volume (L) n(NH4+)= cv = 0,15* 20 10-3 = 3,0 10-3 mol. n(HO-)= c1v1 = 0,15* 10 10-3 = 1,5 10-3 mol. Quantité de matière d'ions hydroxyde à l'état final : [H3O+(aq)] = 10-pH ; [H3O+(aq)] [HO-(aq)]= 10-14 ; [HO-(aq)]= 10-14 / [H3O+(aq)] = 10-14 /10-pH =10-14+pH [HO-(aq)]=10-14+9,2 = 10-4,8 =1,6 10-5 mol/L Volume de la solution dans le becher : 30 10-3 L. n(HO-) f = 1,6 10-5* 30 10-3 = 4,8 10-7 mol. avancement final xf : c1v1 -xf = 4,8 10-7 ; xf =c1v1 -4,8 10-7 = 1,5 10-3 -4,8 10-7 ; xf =1,5 10-3 mol. Avancement maximal xmax : Si NH4+ (aq) est en défaut : cv-xmax=0 ; xmax = cv = 3 10-3 mol Si HO-(aq) est en défaut : c1v1-xmax=0 ; xmax = c1v1 = 1,5 10-3 mol Retenir la plus petite valeur : xmax=1,5 10-3 mol. Taux d'avancement final t : t =xf /xmax=1 : la transformation est totale.
Une solution d'engrais S est obtenue en dissolvant m =6,0 g d'engrais dans une fiole jaugée de volume V= 250 mL. On prépare ensuite deux bechers B1 et B2 suivants :
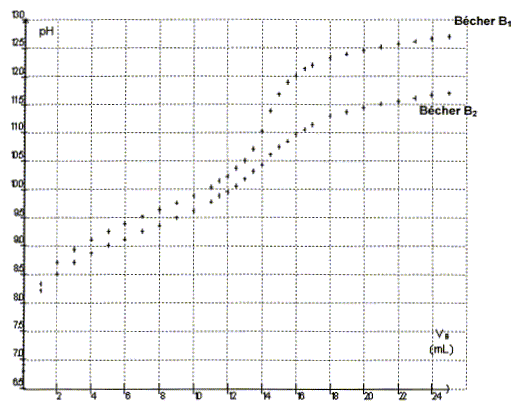
On obtient les courbes pH=f(Va) suivantes :
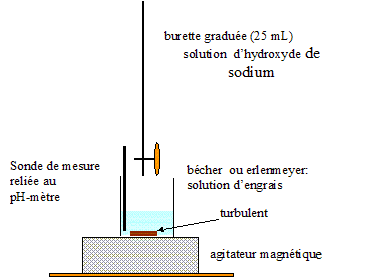
Montage permettant de réaliser le titrage pHmétrique :
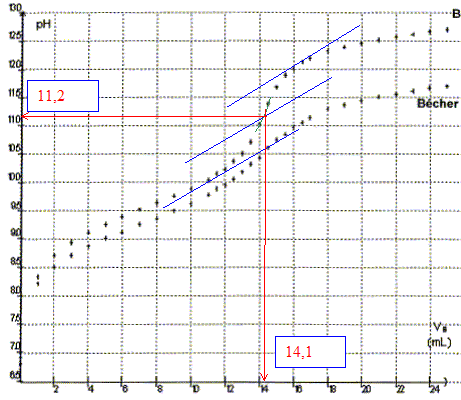
La courbe présentant le plus grand saut de pH, au voisinage de l'équivalence, permet de déterminer les coordonnées du point équivalent avec le plus de précision .
L'ajout d'eau déminéralisée n'a pas d'influence sur le volulme versé à l'équivalence : l'eau déminéralisée n'apporte pratiquement aucun ion hydroxyde et oxonium. La méthode des tangentes appliquée à l'autre courbe conduit à la même valeur du volume équivalent. Autre méthode plus précise pour déterminer le point équivalent : A l'aide d'un système informatique, tracer la courbe dpH/dVa : celle-ci présente un pic à l'équivalence.
A l'équivalence, les quantités de matière des réactifs mis en présence sont en proportions stoechiométriques. Avant l'équivalence l'un des réactifs est en excès ; après l'équivalence, l'autre réatif est en excès. Espèces chimiques présentes à l'équivalence dans le milieu réactionnel : H2O ; NH3(aq) ; Na+(aq) ; NO3-(aq) ( ces deux ions sont spectateurs) HO-(aq), le pH étant supérieur à 7. La présence de la base NH3(aq) donne un milieu basique. Relation entre la quantité d'ions ammonium dosés n0(NH4+) et la quantité d'ion hydroxyde versé à l'équivalence ne( HO-). D'après la définition de l'équivalence : n0(NH4+)=ne( HO-). n0(NH4+)= CB Véq = 0,2*14,1 10-3 = 2,8 10-3 mol. Quantité de matière d'ion ammonium n(NH4+) contenu dans la fiole jaugée de 250 mL : Le volume de la fiole jaugée ( 250 mL) est 25 fois plus grand que celui de la prise d'essai ( 10 mL) : n(NH4+) =25*n0(NH4+)= 25*2,8 10-3 = 7,0 10-2 mol. Quantité de matière de nitrate d'ammonium présente dans cette fiole : NH4NO3(s) = NH4+ (aq) + NO3- (aq). Les coefficients stoechiométriques conduisent à : 7,0 10-2 mol de nitrate d'ammonium. Masse d'azote dans une mole de nitrate d'ammonium NH4NO3 : Cette formule brute contient deux fois l'élément azote ; en conséquence 2*14 = 28 g d'azote par mole. Masse d'azote présente dans l'échantillon : 7,0 10-2 * 28 = 1,96 g ( réponse : 2,0 g). Le pourcentage massique en élément azote est le rapport entre la masse d'azote présente dans l'échantillon et la masse de l'échantillon. Pourcentage massique : 2 /6 = 0,333 soit 33 %. L'écart relatif avec l'indication du fabricant est : (34,4-33,3 )*100 / 34,4 = 3,2 % A 3 % près l'indication du fabricant et le résultat du titrage sont identiques. |
||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||
|
|