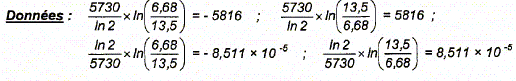|
Radioactivité, datation au carbone 14 bac S 2007 La Réunion |
|||
|
|||
|
La radioactivité naturelle fut découverte en 1896 par H. Besquerel. Le signe le plus perceptible de la radioactivité est l'existence d'un rayonnement émis par les atomes de certains nucléides et dont l'origine se situe au niveau de leur noyau qui est instable. On observe ainsi, par exemple, les rayonnements ( on parle de radioactivité) b ( béta+ ou béta-), qui s'accompagnent souvent d'émission g ( gamma), radiation électromagnétique de même nature que la lumière, provenant du retour à l'état fondamental d'un noyau fils suite à la transmutation d'un noyau père radioactif. Equation de la désintégration nucléaire, diagramme (Z, N) : Parmi les trois types de radioactivité étudiés en classe, citer celle qui n'a pas été évoquée dans le texte plus haut. Donner la composition de la particule émise lors de cette radioactivité.
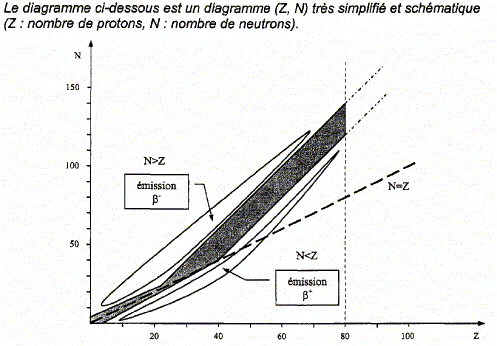
Que représente la zone grisée dans ce diagramme ?
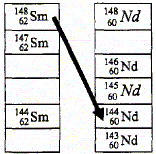
Parmi les trois types de radioactivité étudiés en classe, la radioactivité de type a n'a pas été évoquée dans le texte plus haut. La particule émise lors de cette radioactivité est un noyau d'helium 42He ( 2 protons et 4-2 = 2 neutrons). La zone grisée du diagramme représente la "vallée de la stabilité ", ensemble des noyaux stables. Soit la réaction nucléaire de transmutation indiquée par la flèche ci-dessus : 14862 Sm---> 14460 Nd + AZX Conservation du nombre de nucléons : 148=144+A soit A=4. Conservation de la charge : 62 = 60 + Z soit Z=2 ; donc élément hélium La particule émise est un noyau d'hélium 42He : la radioactivité de type a.
Formation du carbone 14 dans la
haute atmosphère
: Dans la haute atmosphère la réaction qui a lieu entre le neutron et le noyau d'azote 14 s'écrit : 147N + 10n---> AZX + 11p. Vérifier, en justifiant avec
les lois de conservation, que AZX est
bien du carbone 14.
L'azote 14 147N et le carbone 14 146C ne sont donc pas isotopes. 147N + 10n---> AZX + 11p Conservation de la charge : 7 = 1+Z d'où Z= 6, élément carbone. Conservation du nombre de
nucléons : 14+1 = A+1 d'où A = 14.
L'étude de l'évolution de la population moyenne d'un ensemble de noyaux radioactifs permet d'écrire : DN= - l N Dt où N est le nombre de noyaux à la date t et DN est la variation du nombre de noyaux pendant la durée Dt. Cette relation conduit à la loi de décroissance radioactive N(t) = N0 exp (-lt), dans laquelle N0 est le nombre de noyaux à la date t=0.
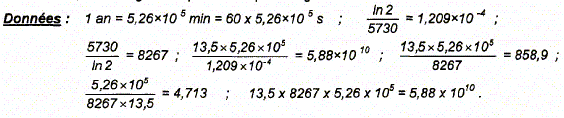
l est la constante radioactive. Définition de la demi-vie ou période du carbone 14 : Durée au bout de laquelle la
moitié des noyaux initiaux se sont
désintégrés. d'où : 0,5 N0 = N0 exp (-lt½) ; 0,5 = exp (-lt½) ln 0,5 = -lt½ ; -ln 2 = - lt½ ; l
= ln2
/t½. ln 2 est sans dimension ; t½ a la dimension d'un temps donc [ln2 /t½] = T-1. La constante radioactive est l'inverse d'un temps. Montrons que l'activité A à l'instant t et le nombre N de noyaux présents dans l'échantillon à la date t sont liés par la relation : A = l N. A = - dN/dt avec N = N0 exp (-lt) dN/dt = -l N0 exp (-lt) = - l N d'où A = l N. Calcul du nombre N d'atomes de carbone 14 dans 1 g de carbone tel que A= 13,5 désintégrations par minute et par gramme de carbone : N = A/l avec A = 13,5 / 60 Bq. l = ln2 /t½ ; 1/l = t½/ ln2 avec t½ = 5730 ans = 60*5,26 105 s. N= 13,5 / 60 * 5730*60*5,26 105 / ln 2 = 5730 / ln 2 *13,5*5,26 105 N=8267*13,5*5,26 105 = 5,88 1010.
La loi de décroissance radioactive peut également s'écrire en fonction de l'activité , A(t) =A0 exp (-lt), dans laquelle A0 est l'activité à la date t=0 et A l'activité mesurée à l'instant t. Le prélèvement d'une poutre en bois dans une tombe au Sahara fournit une activité au moment de la mesure telle que A= 6,68 désintégrations par minute et par gramme de carbone alors que A0 = 13,5 désintégrations par minute et par gramme de carbone. Démontrer que l'expression qui permet de donner l'âge de la mort d'un organisme s'écrit : t = t½ / ln 2 * ln(A0/A) avec t½ = 5730 ans. Calculer en faisant apparaître l'application numérique, l'âge t de la tombe de ce vizir de la première dynastie des pharaons.
A(t) /A0 = exp (-lt) ; ln [A(t) /A0 ] = -lt ; ln [A0/A(t) ] =lt ; ln [A0/A(t) ] = t ln2 / t½ ; t = t½ / ln 2 * ln(A0/A) t =5730 / ln2 * ln(13,5 / 6,68) = 5816 ans. |
|||
|
|
|||
|
|