|
bac S Polynésie 2007 : à propos du lait, tensioactifs, acide lactique. |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
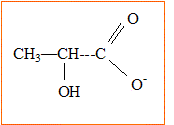
Naturellement le lait n'est pas qu'eau et matières grasses, car les deux corps ne se mélangent pas : du beurre fondu et de l'eau restent séparés... De fait le lait contient également des protéines et diverses autres molécules tensioactives, c'est à dire qui ont une partie soluble dans l'eau et une partie soluble dans la matière grasse. En plaçant au contact de l'eau leur partie soluble dans l'eau et au contact de la graisse leur partie soluble dans la graisse, ces molécules tensioactives forment un enrobage qui délimite les globules de matière grasse, les stabilise et assure leur dispersion dans l'eau. Cette stabilisation est renforcée par les molécules de caséine qui, à la surface des globules assurent une répulsion mutuelle de ceux-ci car elles sont négativement chargées. Extrait de : les secrets de la casserole, H. THis, Ed. Belin. Données : Le lactose est le sucre caractéristique du lait. Sous l'action d'enzymes, le lactose se transforme en acide lactique au cours du temps, augmentant l'acidité naturelle du lait. Acide lactique : CH3-CHOH-COOH ; masse molaire M=90 g/mol. Le pKa du couple acido-basique de l'acide lactique est égal à 3,8. On notera AH l'acide lactique. Etude du document :
" du beurre fondu et de l'eau restent séparés" "séparés" signifie : espèces qui ne se mélangent pas. D'où en langage scientifique : le beurre fondu et l'eau sont deux liquides non miscibles. La partie soluble dans l'eau des molécules tensioactives est qualifiée par l'adjectif " hydrophile " ( amie de l'eau ). Schéma d'un globule de matière grasse en suspension dans l'eau : -------------------O longue chaine carbonée lipophile, hydrophobe ; tête hydrophile
Formule semi-développée de l'ion lactate, base conjuguée de l'acide lactique : CH3-CHOH-COO-. Expression de la constante d'acidité Ka du couple acide lactique / ion lactate, noté AH / A- : AH (aq) +H2O = A- (aq) + H3O+(aq). Ka = [A-(aq) ]éq[H3O+(aq)]éq / [AH (aq) ]éq. Concentration en ion oxonium de la solution : [H3O+(aq)]éq = 10-pH = 10-2,9 = 1,3 10-3 mol/L. Taux d'avancement t de la réaction de l'acide lactique avec l'eau. Le tableau ci-dessous est établi pour un volume de solution V= 1 L.
t =10-2,9 / 10-2 = 10-0,9 ; t = 0,13. Le taux d'avancement final étant très inférieur à 1, la réaction de l'acide lactique avec l'eau est limitée. Valeur de la constante Ka du couple de l'acide lactique : [A-(aq) ]éq= [H3O+(aq)]éq =10-pH = 10-2,9 = 1,258 10-3 mol/L La conservation de l'élément carbone s'écrit : [A-(aq) ]éq+[AH (aq) ]éq = c = 10-2 mol/L [AH (aq) ]éq =10-2 -1,258 10-3 =8,74 10-3 mlol/L Ka = [A-(aq) ]éq[H3O+(aq)]éq / [AH (aq) ]éq. Ka = 1,258 10-3* 1,258 10-3 / 8,74 10-3 ; Ka = 1,8 10-4. pKa = - log Ka = - log 1,81 10-4 ; pKa = 3,7. L'écart avec la valeur indiquée (3,8) est sans doute due à une mesure imprécise du pH.
Dosage de l'acide lactique dans un lait : On introduit dans un erlenmeyer vA=20,0 mL d'un échantillon de lait et quelques gouttes de phénolphtalèine. On ajoute progressivement une solution d'hydroxyde de sodium de concentration cb= 5,0 10-2 mol/L. Le changement de couleur du milieu réactionnel est observé pour un volume de solution d'hydroxyde de sodium ajouté égal à 9,2 mL.
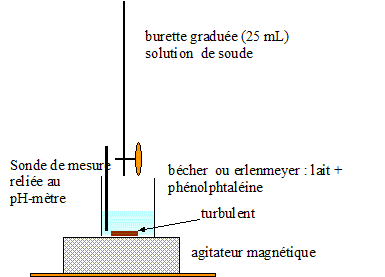
Equation de la réaction entre l'acide lactique et l'ion hydroxyde HO-. AH (aq)+ HO- (aq) = H2O + A-(aq) Concentration molaire de l'acide lactique du lait étudié. A l'équivalence les quantité de matière des réactifs mis en présence sont en proportions stoechiométriques cvA = cB véqui ; c= cB véqui / vA =9,2* 0,05/20 ; c = 2,3 10-2 mol/L. titre massique d'acide lactique (g/L) = concentration (mol/L) * masse molaire (g/mol) t = 0,023*90 =2,1 g/L. Cette valeur étant supérieure à la norme (1,8 g/L), le lait n'est pas frais. |
||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||
|
|