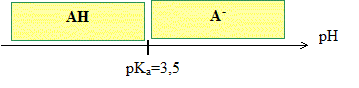|
aspirine de synthèse bac Nlle Calédonie 2007 |
||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||
|
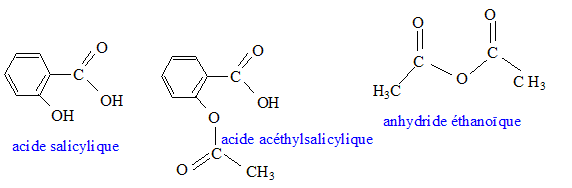
En 1825 un pharmacien italien, Francesco Fontana isole le "principe actif" de l'écorce de saule et le baptise salicine. Par la suite la salicine donnera de l'acide salicylique, plus efficace, puis un procédé de synthèse à partir de l'acide salicylique produira l'acide acéthylsalicylique. C'est la naissance de l'aspirine mise sur le marché en 1899. Données :
Masse molaire ( g/mol) : acide salicylique : 138 ; anhydride éthanoïque : 102 ; acide acéthylsalicylique : 180. Masse volumique de l'anhydride éthanoïque r =1,08 103 kg m-3. pKa du couple acide acéthylsalicylique / ion acéthylsalicylate : 3,5 à la température de l'expérience. L'acide acéthylsalicylique est très peu soluble dans l'eau.
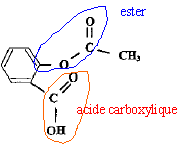
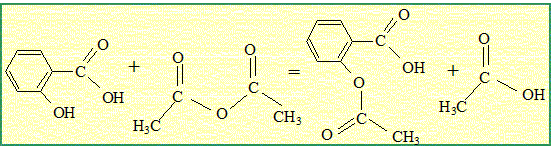
Nécessité de l'aspirine de synthèse. Chaque année, environ 40 000 tonnes d'aspirine sont consommées à travers le monde. Un saule nécessite une superficie de terre d'environ 20 m² pour son développement et pourrait fournir 2,6 kg d'aspirine. A titre d'exemple la superficie de la ville de Paris couvre 10 500 ha. Sur quelle surface de terre exprimée en hectares ( 1 ha = 10 000 m²) devrait-on abattre des saules, chaque années, pour produire l'aspirine uniquement à partir des saules ? Le résultat confirme t-il la nécessité de synthétiser l'aspirine ? Aide aux calculs : 40 / 2,6 =15 ; 40*2,6 = 104. 40 000 tonnes = 4 104*103 kg = 40 106 kg. nombre de saules : 40 106 / 2,6 = 15 106 surface de terre : 15 106 *20 = 3,0 108 m2 = 3,0 104 ha. 3,0 104 / 10500 voisin de 3 fois superficie de la ville de Paris. Cette valeur confirme la nécessité de la synthèse. Synthèse de l'aspirine en laboratoire. On réalise la synthèse de l'aspirine à partir de l'anhydride éthanoïque et de l'acide salicylique. Les produit de la transformation sont l'aspirine et l'acide éthanoïque. Sur le schéma de la molécule d'aspirine ( acide acéthylsalicylique ) entourer et nommer les groupes caractéristiques.
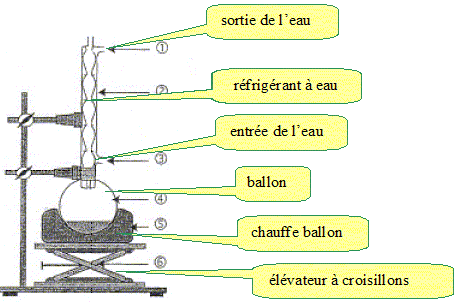
Etape A : ajouter de l'eau froide dans le milieu réactionnel. Etape B : réaliser un montage de chauffage à reflux et chauffer pendant une vingtaine de minutes. Etape C : les cristaux récupérés sont impurs. Les purifier par recristallisation. Filtrer de nouveau sur büchner et peser les cristaux récupérés. Etape D : introduire dans un ballon 5,0 g d'acide salicylique, 10 mL d'anhydride éthanoïque et quelques gouttes d'acide sulfurique. Etape E : filtrer sur büchner le mélange obtenu et récupérer les cristaux d'aspirine. Indiquer l'ordre des étapes qu'il faut mener pour réaliser la synthèse de l'aspirine. Etape D ; étape B ; étape A ; étape E ; étape C. Par quel autre composé aurait-on pu remplacer l'anhydride éthanoïque ? acide acétique ou acide éthanoïque. Quel(s) avantage(s) apporte l'utilisation de l'anhydride éthanoïque ? Réaction totale et rapide, donc rendement maximum. Quel est le rôle de l'acide sulfurique ? Catalyseur.
Nommer les points du montage numérotés.
Quel est l'intérêt du montage à reflux ? En travailant à
température modérée on augmente la
vitesse de la réaction tout en évitant les
pertes de matière. Les vapeurs se condensent dans le
réfrigérant à eau et retombent dans le
milieu réactionnel.
Lors d'une séance de TP, un groupe d'élèves applique le protocole ci-dessus. Vérifier que l'anhydride éthanoïque est en excès au début de la transformation. anhydride éthanoïque : masse (g) = volume (mL) * masse volumique (g/mL) m = 10*1,08 = 10,8 g quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 10,8 / 102 = 0,11 mol. acide salicylique : n = m/M =5,0/138 =0,036 mol. D'après les nombres stoechiométriques de l'équation ci-dessous, 0,036 mol d'acide salicylique réagit avec 0,036 mol d'anhydride éthanoïque. Or il y a 0,11 mol d'anhydride : celle-ci est donc en excès de 0,11-0,036 = 0,074 mol. Aide aux calculs :
5/138 =0,036 ; 10,8/102 = 0,11 ; 5*138 = 690 ; 102/10,8 =
9,44.
Compléter le tableau d'avancement et déterminer le rendement de la transformation. Aide aux calculs : 6/180 = 0,033 ; 36/33 = 1,1 ; 33/36 =0,92.
quantité de matière théorique d'aspirine = xmax = 0,036 mol rendement = xf /xmax =0,033/0,036 =
33/36 = 0,92 (92 %).
Les médicaments à base d'aspirine se présentent sous diverses formulations : comprimés, poudre, comprimés effervescents... On notera l'acide acéthysalicylique AH et l'ion acéthylsalicylate A-. On dissout un comprimé contenant 500 mg d'aspirine simple dans de l'eau distillée de façon à obtenir un volume Vs= 200 mL de solution S. L'acide acéthylsalicylique réagit avec l'eau. Ecrire l'équation de la réaction modélisant la transformation. AH + H2O = A- + H3O+. Calculer la concentration molaire cs en soluté apporté de la solution S. Aide aux calculs : 2,50 /180 = 1,4 10-2 ; 2,5*180 = 4,5 10-2. quantité de matière (mol) = masse (g) / masse molaire aspirine (g/mol) n= 0,500 / 180 mol concentration (mol/L) = quantité de matière (mol) / volume (L) cs =n/V avec V = 0,2 L ;
cs =0,500/(180*0,2) = 5/(180*2) = 2,5 / 180 =
1,4 10-2
mol/L.
Tracer le diagramme de prédominance des espèces chimiques du couple AH /A - .
Sous quelle forme AH ou A-, l'organisme de cet individu assimile t-il l'aspirine dans l'estomac ? Le pH de l'estomac est pH=2 : à pH inférieur à pKa, la forme acide AH prédomine.
|
||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||