|
bac Nlle Calédonie 2007 : transport du dioxygène dans le sang (6,5 pts) |
|||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
|
Une molécule d'hémoglobine est constituée de plusieurs sous-unités. On ne considèrera dans tout l'exercice que la sous-unité notée Hb(aq). Le dioxygène est transporté de deux façons dans l'organisme : sous forme de dioxygène dissous dans le sang que l'on note O2(aq) et sous forme d'oxyhémoglobine que l'on notera HbO2(aq). Le sang est assimilé à une solution aqueuse. M(Hb) = 1,6 104 g/mol. I. Transport du dioxygène dans l'organisme par l'hémoglobine du sang : Au niveau des poumons, une sous-unité d'hémoglobine fixe une molécule de dioxygène pour donner une sous-unité d'oxyhémoglobine. L'équation de la réaction associée à la transformation chimique est : Hb(aq) + O2(aq) = HbO2(aq) (1)
II. Libération du dioxygène au niveau des organes : Le volume V de sang étudié dans la partie 1 arrive au niveau des tissus des organes. A ce stade une partie du dioxygène dissous est absorbée par les tissus faisant ainsi chuter la concentration en dioxygène dans le sang. Le système chimique étudié dans la partie 1 se trouve alors dans un nouvel état initial, noté état 1, tel que la concentration en dioxygène dissous est [O2]1 = 3,6 10 -5 mol/L ; celle de sous-unités d'hémoglobine est alors [Hb]1 = 2,8 10-4 mol/L et celle de sous-unités d'oxyhémoglobine est [HbO2]1 = 9,1 10-3 mol/L.
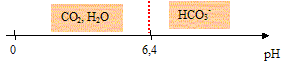
III. Et lors d'un effort musculaire ? Données : au cours d'un effort, du dioxyde de carbone est formé au niveau des muscles. Il se dissout dans le sang. Le couple acide-base mis en jeu est : CO2 , H2O / HCO3-(aq) de pKa = 6,4.
IV. Empoisonnement au monoxyde de carbone : La combustion d'une substance contenant du carbone produit du monoxyde de carbone dans certaines conditions, par exemple dans les poêles ou fourneaux mal aérés, ou dans la fumée de cigarettes. L'équation associée à la réaction entre le monoxyde de carbone et une sous-unité d'hémoglobine s'écrit : Hb(aq) + CO(aq) = HbCO(aq) (4) avec K4 = 7,5 107 Le tableau suivant donne les effets sur l'organisme associés aux valeurs du rapport des concentrations à l'équilibre.
corrigé A l'état initial, on suppose qu'un volume V = 100 mL de sang contient une quantité de sous-unités d'hémoglobine notée n0 , un excès de dioxygène et ne contient pas de sous-unités d'oxyhémoglobine. Ce volume V de sang contient une masse m = 15 g de sous-unités d'hémoglobine. Calcul de la quantité de matière n0 de sous-unités d'hémoglobine correspondante : n0 = m/ M(Hb) =15/ 1,6 104 = 9,375 10-4 ( réponse n0 = 9,4 10-4 mol) . tableau d'évolution du système :
Le taux d'avancement final tf de la réaction chimique (1) a pour valeur 0,97. Relation qui définit le taux d'avancement final tf : tf = xf / xmax =0,97 Valeur xf de l'avancement final : xf = tf xmax =0,97 * 9,375 10-4 ; xf = 9,1 10-4 mol. Quantité de sous-unités d'oxyhémoglobine HbO2 formée dans l'état final : xf = 9,1 10-4 mol. ( 9,094 10-4 mol) En une minute, le débit cardiaque moyen permet de traiter VS = 5,0 L de sang au niveau des poumons. Dans un volume V= 0,1 L la quantité de sous-unités d'oxyhémoglobine HbO2 formée vaut : 9,094 10-4 mol Quantité correspondante nS de sous-unités d'oxyhémoglobine HbO2 formées dans un volume de 5 L : nS = 9,094 10-4 *50 ; nS
= 4,5 10-2
mol.
Le volume V de sang étudié dans la partie 1 arrive au niveau des tissus des organes. A ce stade une partie du dioxygène dissous est absorbée par les tissus faisant ainsi chuter la concentration en dioxygène dans le sang. Le système chimique étudié dans la partie 1 se trouve alors dans un nouvel état initial, noté état 1, tel que la concentration en dioxygène dissous est [O2]1 = 3,6 10 -5 mol/L ; celle de sous-unités d'hémoglobine est alors [Hb]1 = 2,8 10-4 mol/L et celle de sous-unités d'oxyhémoglobine est [HbO2]1 = 9,1 10-3 mol/L. Valeur du quotient de réaction Qr1 dans l'état 1 correspondant à l'équation (1) : Qr1 =[HbO2]1 /([O2]1[Hb]1) = 9,1 10-3 / (3,6 10 -5 *2,8 10-4) ; Qr1 =9,0 105. La constante d'équilibre K1 liée
à l'équation
(1) a pour valeur
K1 = 3,0 105. Qr1 >
K1 : le système évolue dans le sens
indirect.
Données : au cours d'un effort, du dioxyde de carbone est formé au niveau des muscles. Il se dissout dans le sang. Le couple acide-base mis en jeu est : CO2 , H2O / HCO3-(aq) de pKa = 6,4. Equation de la réaction associée à la transformation entre le dioxyde de carbone dissous et l'eau : CO2 , H2O + H2O = HCO3- + H3O+ (2) Domaines de prédominance des espèces du couple CO2 , H2O / HCO3-(aq) :
Espèce prédominante de ce couple dans le sang au niveau des tissus pour un pH du sang égal à 7,4 : à pH supérieur à pKa=6,4, l'espèce prédominante est la forme base du couple acide base c'est à dire HCO3- La dissolution du dioxyde de carbone libère dans le sang des ions oxonium d'après (2) ; la concentration de ces ions augmente ; or pH = - log[H3O+] : en conséquence le pH sanguin va diminuer en l'absence d'autres réactions. Chez l'homme, le pH du sang est compris dans des limites très étroites : 7,36 à 7,42. D'autre part, l'oxyhémoglobine peut réagir avec les ions oxonium selon l'équation : HbO2(aq) + H3O+ = O2(aq) + HbH+(aq) + H2O (3) D'une part la réaction (3) consomme une partie des ions H3O+ produit par la réaction d'équation (2) : donc la variation du pH du sang sera limitée. D'autre part la réaction
(3) libère du
dioxygène nécessaire à l'effort
musculaire.
La combustion d'une substance contenant du carbone produit du monoxyde de carbone dans certaines conditions, par exemple dans les poêles ou fourneaux mal aérés, ou dans la fumée de cigarettes. L'équation associée à la réaction entre le monoxyde de carbone et une sous-unité d'hémoglobine s'écrit : Hb(aq) + CO(aq) = HbCO(aq) (4) avec K4 = 7,5 107 Le tableau suivant donne les effets sur l'organisme associés aux valeurs du rapport des concentrations à l'équilibre.
L'analyse du sang d'une personne ayant respiré de l'air pollué par du monoxyde de carbone a révélé une concentration en monoxyde de carbone dissous dans le sang égale à 2,4 104 mol/L. La personne ressent des maux de tête. Au sein de l'organisme il y a donc compétition
entre le dioxygène et le monoxyde de carbone pour se
fixer sur l'hémoglobine (équations 1 et 4). On
atteint un état d'équilibre correspondant
à l'équation : HbO2(aq) + CO(aq) =
HbCO(aq) + O2(aq) (
5) K5 = [HbCO]éq[O2]éq / ([HbO2]éq[CO]éq) Hb(aq) + CO(aq) = HbCO(aq) (4) avec K4 =[HbCO]éq / ([Hb]éq[CO]éq)= 7,5 107 Hb(aq) + O2(aq) = HbO2(aq) (1) avec K1 =[HbO2]éq / ([Hb]éq[O2]éq)= 3,0 105. K4 / K1 =[HbCO]éq[O2]éq/ ([HbO2]éq[CO]éq) = K5. K5= 7,5 107 / 3,0 105 = 2,5 102. Une personne empoisonnée au monoxyde de carbone est placée dans un caisson hyperbare dans lequel on impose une concentration élevée en dioxygène permettant ainsi d'augmenter la concentration de dioxygène dissous dans le sang. Action du caisson hyperbare : en travaillant sous pression de dioxygène supérieure à la pression atmosphérique, on déplace l'équilibre 5 dans le sens indirect ; c'est à dire libération du CO dissout dans le sang et formation de HbO2(aq) |
|||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||
|
|