|
bac Inde 2007 : Quelques propriétés des solutions de nitrate d'argent et d'ammoniac (7 points) |
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
Constante d'équilibre associée à l'équation de la réaction d'oxydo-réduction entre le cuivre et les ions argent(I) : K= 2,15 1015. Conductivité molaire ionique en mS m2 mol-1 : lNH4+ = 7,4 ; lHO- = 19,8 ; lH3O+ = 35,0. Masse atomique molaire ( g/mol) : Ag : 108 ; Cu : 63,6 ; 1 faraday = e NA = 9,65 104 C mol-1. I- Constante d'acidité du couple NH4+(aq) /NH3(aq). On dissout du gaz ammoniac dans de l'eau et on obtient la solution S.
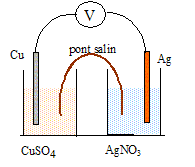
II- Nitrate d'argent et cuivre : On plonge un gros fil de cuivre dans un erlenmeyer
contenant une solution de nitrate d'argent (I)
Ag+(aq) + NO3-(aq).
Progressivement :
I- Constante d'acidité du couple NH4+(aq) /NH3(aq). Equation de la réaction de l'ammoniac sur l'eau : NH3 (aq) + H2O = NH4+(aq) + HO-(aq). Cette réaction conduit à la formation d'une base forte, l'ion HO-(aq). Or le produit ionique de l'eau s'écrit : Ke = [HO-][H3O+] ; si [HO-] augmente, alors [H3O+] diminue ; le pH devient inférieur à 7 et la solution S est basique. Expression de la conductivité d'une solution d'ammoniac : s = lNH4+ [ NH4+] + lHO-[HO-] La solution étant électriquement neutre ( et H3O+ étant minoritaire) alors [ NH4+] = [HO-] d'où s = ( lNH4+ + lHO-) [ HO-] = ( lNH4+ + lHO-) [ NH4+]. La conductivité d'une solution d'ammoniac à 1,00 10-2 mol/L = 10,0 mol m-3 vaut 10,9 10-3S m2 mol-1. Concentration molaire effective des ions ammonium et des ions hydroxyde dans la solution : [ NH4+] = [ HO-] = s / ( lNH4+ + lHO-) = 10,9 10-3 /((7,4 + 19,8) 10-3) =4,01 10-1 mol m-3 = 4,01 10-4 mol L-1. Concentration molaire effective des ions oxonium et des molécules d'ammoniac NH3 : Le produit ionique de l'eau s'écrit : Ke = [HO-][H3O+] soit : [H3O+] = Ke / [HO-] = 10-14 / 4,01 10-4 = 2,49 10-11 mol/L. Conservation de l'élément azote : [ NH4+] + [NH3]= 1,00 10-2 mol/L [NH3]= 1,00 10-2 -[ NH4+] = 1,00 10-2 -4,01 10-4 = 9,60 10-3 mol/L. Expression de la constante d'acidité du couple ammonium/ammoniac : NH4++ H2O = NH3 + H3O+ Ka = [NH3][H3O+]/[NH4+]. Ka = 9,6 10-3 *2,49 10-11 / 4,01 10-4 = 5,96 10-10. pKa = -log Ka = -log 5,96 10-10 = 9,22. Valeur en accord avec la valeur donnée 9,24. ( écart relatif : (9,24-9,22)*100 / 9,2 =0,2 %).
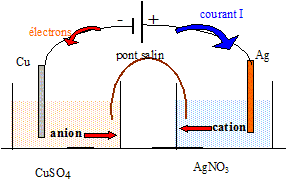
On plonge un gros fil de cuivre dans un erlenmeyer contenant une solution de nitrate d'argent (I) Ag+(aq) + NO3-(aq). Progressivement : - Des filaments d'argent se forment sur le cuivre ( arbre de Diane) : réduction de l'ion Ag+(aq) : 2Ag+(aq) + 2e- =2Ag(s). Equation de la réaction d'oxydo-réduction : 2Ag+(aq) +Cu(s) = Cu2+(aq) + 2Ag(s) Pile cuivre-argent
: Quotient de réaction dans l'état initial du système : Qr i = [Cu2+]i / [Ag+]i2=1,5 / (2,64 10-8)2=2,15 1015. Qr i = K, le système se trouve dans un état d'équilibre chimique : cette pile ne peut pas débiter de courant. La pile est branchée aux bornes d'un générateur, la plaque d'argent étant reliée à la borne positive, la plaque de cuivre à la borne négative.
Les électrons sont les porteurs de charge à l'extérieur de la pile ; les ions sont les porteurs de charge à l'intérieur de la pile. Equation de la réaction qui modélise la transformation qui se produit dans la pile : Des électrons arrivent sur l'électrode de cuivre ; celle-ci constitue la cathode sur laquelle se produit la réduction des ions Cu2+(aq) : Cu2+(aq) + 2e-= Cu(s). L'argent constitue l'anode sur laquelle se produit l'oxydation de l'argent : 2Ag(s) = 2Ag+(aq) + 2e- . Cu2+(aq) +2Ag(s) =Cu(s) + 2Ag+(aq). Tableau descriptif de l'évolution du système :
Q=It = 0,15*3600 = 540 C Quantité de matière d'électrons : n(e) = 540/96500 = 5,60 10-3 mol. or Ag(s) = Ag+(aq) + e- d'où n(Ag) = n(e) =5,60 10-3 mol soit xfin = 0,5*5,60 10-3 =2,80 10-3 mol. Concentration en ion Cu2+(aq) et Ag+(aq) après passage du courant : n(Cu2+)=0,03-xfin =0,03-2,8 10-3 = 2,72 10-2 mol V= 0,02 L d'où [Cu2+]=2,72 10-2 / 0,02 = 1,36 mol/L. n(Ag+)=2xfin =5,60 10-3 mol V= 0,02 L d'où [Ag+]=5,60 10-3 / 0,02 = 0,280 mol/L. |
|||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||
|
|