|
synthèse d'un conservateur, l'acide benzoïque bac S 2007 France |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
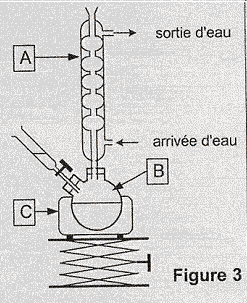
L'acide benzoïque est un conservateur présent dans de nombreuses boissons sans alcool. Son code européen est E 210. Il peut être préparé par synthèse en laboratoire. Principe de cette synthèse : l'oxydation en milieu basique et à chaud de l'alcool benzylique C6H5CH2OH par les ions permanganate MnO4- en excès, conduit à la formation d'ions benzoate et de dioxyde de manganèse MnO2 (solide brun). Cette transformation est totale. Apres réduction, par l'éthanol, des ions permanganate excédentaires et élimination du dioxyde de manganèse MnO2, on obtient une solution incolore contenant les ions benzoate. L'addition d'acide chlorhydrique à cette solution permet la cristallisation de l'acide benzoïque C6H5 COO2H (solide blanc), que l'on recueille après filtration, lavage et séchage. Questions relatives au protocole expérimental : Donner, sans justifier, le nom des parties manquantes (verrerie, nom de montage...), notées de 1 à 3 dans le texte de l'encadré ci-dessous décrivant le protocole expérimental. Formation de l'acide benzoïque : Après avoir versé dans un ballon bicol posé sur un valet et sous la hotte un volume V1 = 2,0 mL d'alcool benzylique puis bouché l'ensemble, on ajoute environ 20 mL de soude de concentration 2 mol/L à l'aide d' (1). On introduit ensuite quelques grains de pierre ponce dans le ballon pour réguler l'ébullition lors du chauffage.
Nommer sur la copie les éléments du montage de la figure 3 ci-dessus repérés par les lettres A, B et C On ajoute environ 20 mL de soude de concentration 2 mol/L à l'aide d'une ampoule de coulée, ou d'un entonoir à robinet. On réalise alors un chauffage à reflux, permettant de chauffer le mélange sans perte de matière ni surpression. On filtre le mélange obtenu, rapidement, en utilisant un ensemble de filtration sous vide ( buchner). A : colonne de Vigreux ; B : ballon bicol ; C : chauffe ballon.
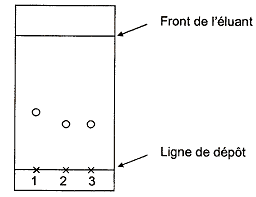
Afin de caractériser le produit
formé, on réalise une chromatographie
sur couche mince. Dans trois tubes à essais, on verse 1 mL
d'éluant E ; dans le tube 1 on ajoute une
goutte d'alcool benzylique, dans le tube 2 une
pointe de spatule du solide obtenu et dans le tube
3 une pointe de spatule d'acide benzoïque
pur. On réalise une chromatographie sur couche
mince à partir des trois tubes et
l'éluant E puis on relève le
chromatogramme sous rayonnement UV. Interpréter le chromatogramme
réalisé lors de la synthèse et
conclure quant à la nature du solide
obtenu. Les taches 2 et 3 ont
le même rapport frontal : 2 est
identifié à l'acide
benzoïque. Répondre, dans cette seconde partie, en choisissant la bonne réponse. Justifier clairement ce choix (définition, expression littérale et application numérique, tableau d'avancement...).
3C6H5-CH2OH + 4MnO4-(aq)= 3C6H5-COO- (aq) + 4H2O + 4MnO2(s)+ HO-(aq) Les couples oxydant/réducteur mis en jeu lors de la synthèse de l'acide benzoïque sont les suivants : C6H5-COO- (aq) / C6H5-CH2OH et MnO4-(aq)/ MnO2(s) Choisir les deux demi-équations électroniques associées à la transformation décrite ci-dessus. (a) C6H5-COO- (aq) + 4e- + 4H2O = C6H5-CH2OH + 5 HO-(aq) correct. (b) C6H5-COO- (aq) + 4e- + 5H+(aq) = C6H5-CH2OH + H2O incorrect. En milieu basique H+ est minoritaire. (c) MnO4-(aq) + 5e- + 8H+(aq) =Mn2+(aq) +4 H2O.incorrect. Cette écriture correspond au couple MnO4-(aq)/Mn2+(aq) en milieu acide. (d) MnO4-(aq) + 3e- + 2H2O =MnO2(s) + 4 HO-(aq) correct. (e) MnO4-(aq) + 3e- + 4H+(aq) =MnO2(s) + 2H2O. incorrect. En milieu basique H+ est
minoritaire.
conservation de l'élément carbone : C6H5-COO- (aq) + ... = C6H5-CH2OH + ... conservation des éléments oxygène et hydrogène : ajouter H2O ou HO-. C6H5-COO- (aq) + 4H2O + ... = C6H5-CH2OH +5 HO- + .. . conservation de la charge : ajouter des électrons à gauche ( il s'agit d'une réduction) C6H5-COO- (aq)
+ 4H2O +
4 e-
=
C6H5-CH2OH
+5 HO-
.
conservation de l'élément manganèse : MnO4-(aq)+ ... = MnO2(s) +... conservation des éléments oxygène et hydrogène : ajouter H2O ou HO-. MnO4-(aq)+ 2H2O +.... = MnO2(s) +4 HO-(aq). conservation de la charge : ajouter des électrons à gauche ( il s'agit d'une réduction) MnO4-(aq)+ 2H2O + 3 e-= MnO2(s) +4 HO-(aq).
Aide aux calculs : 2,0/108 = 1,9 10-2 ; 108/2,0 = 54 ; 2,0 10-3 / 108 = 1,9 10-5. masse (g) = volume (mL) * masse volumique (g/mL) ; m1= 2*1,0 = 2,0 g Quantité de matière (mol) = masse (g) / masse molaire (g/mol) n1 = m1/M1 = 2,0/108 = 1,9 10-2 mol.
Lors de l'oxydation de l'alcool benzylique, les ions permanganate doivent être introduits en excès. Choisir la bonne proposition (on pourra s'aider d'un tableau d'évolution du système). a) Les ions permanganate ont été introduits en excès ; b) Les ions permanganate n'ont pas été introduits en excès. Aide aux calculs : 1,9/3 = 0,63 ; 1,9*3 = 5,7.
Si MnO4-(aq) est en défaut : n2-4xmax=0 ; xmax=n2/4 = 3,0 10-2 /43 = 7,5 10-3 mol Retenir la plus petite valeur :
C6H5-CH2OH
en défaut et MnO4-(aq) en
excès.
C6H5-COO- (aq) + H3O+(aq) = C6H5-COOH(s) + H2O. La masse théorique maximale mmax d'acide benzoïque qu'il aurait été possible d'obtenir vaut : 1,6 10-2 g ; 6,6 g ; 2,3 g. Aide aux calculs : 1,9/122 = 1,6 10-2 ; 5,4*122 = 6,6 102 ; 1,9*122 = 2,3 102. La quantité de matière d'ion benzoate obtenue est égale à 3xmax = 3*6,3 10-3 =1,9 10-2 mol La quantité d'acide benzoïque vaut 1,9 10-2 mol. masse(g) = quantité de matière (mol) * masse molaire (g/mol) m = 1,9 10-2 * 122 =
2,3 g.
rendement = masse réelle/ masse théorique * 100 . "On récupère les cristaux d'acide benzoïque sur une coupelle préalablement pesée dont la masse est m = 140,4 g. On les sèche dans une étuve, puis on pèse l'ensemble et on trouve une masse m' = 141,8 g." masse réelle = m'-m = 1,4 g. 1,4/2,3*100 = 61 %. |
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|