|
estérification : benzoate de méthyle : quotient de réaction, taux d'avancement final, déplacement de l'équilibre bac S Polynésie 09/04 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
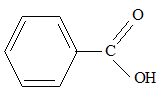
On utilise en parfumerie des esters odorants en particulier le benzoate de méthyle de formule C6H5-COO-CH3. On obtient celui-ci par une réaction d'estérification entre l'acide benzoïque et un alcool A en présence d'acide sulfurique. On donne les masses molaires ( g/mol) : acide benzoïque : 122 ; alcool A : 32 ; benzoate de méthyle : 136. Constante d'équilibre K associée à cette estérification K = 4 Nom de l'alcool A : méthanol CH3-OH Formule
semi-développée de l'acide benzoïque
: Equation de la réaction d'estérification : C6H5-COOH + CH3-OH = C6H5-COO-CH3 + H2O. Expression littérale du quotient de réaction à l'équililibre Qr, éq : Qr éq =[C6H5-COO-CH3]éq[H2O]éq / ([CH3-OH]éq[C6H5-COOH]éq) =K = 4. Taux d'avancement final t : L'estérification est réalisée à partir d'un mélange équimolaire de réactifs (0,20 mol d'alcool A et 0,20 mol d'acide benzoïque).
Qr éq = x2eq /(0,20-xeq)2 = 4 xeq /(0,20-xeq) =2 soit xeq =0,1333 ( 0,13 mol) t =xeq /xmax = 0,1333 / 0,20 ; t = 0,67. Composition finale du mélange :
On réalise un nouveau mélange initial (0,50 mol d'alcool A et 0,20 mol d'acide benzoïque). Valeur de l'avancement x'éq à l'équilibre :
x'2eq = 4(0,20-x'eq)(0,50-x'eq) x'2eq =0,40-2,8 x'eq+4x'2eq ; 3x'2eq -2,8 x'eq+ 0,4 = 0 D= 2,82-4*0,4*3 = 3,04 ; D ½= 1,74 x'eq=(2,8-1,74)/6 = 0,1767 x'eq= 0,18. ( l'autre valeur étant supérieure à 0,20 n'est pas à retenir ). Taux d'avancement final : si l'acide benzoïque est le réactif limitant : 0,20 - xmax = 0 soit xmax = 0,20 mol si le méthanol est en défaut : 0,50 - xmax = 0 soit xmax = 0,50 mol L'acide benzoïque est donc en défaut et xmax = 0,20 mol t =x'eq /xmax = 0,1767 / 0,20 ; t = 0,88. Conclusion : L'ajout d'un réactif en excès déplace l'équilibre vers la droite ; dans le sens direct, consommation de ce réactif.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|