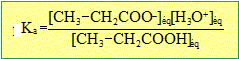|
synthèse de l'arôme d'abricot ; dosage de l'acide propanoïque ; le choux rouge bac S Antilles 09/07 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
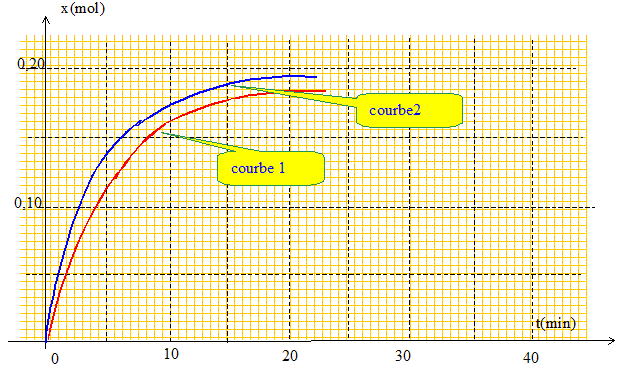
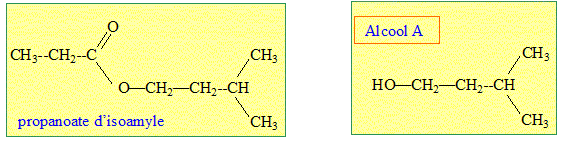
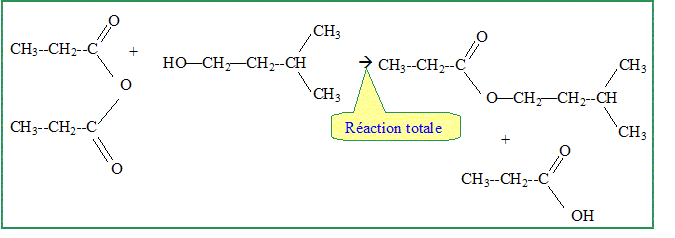
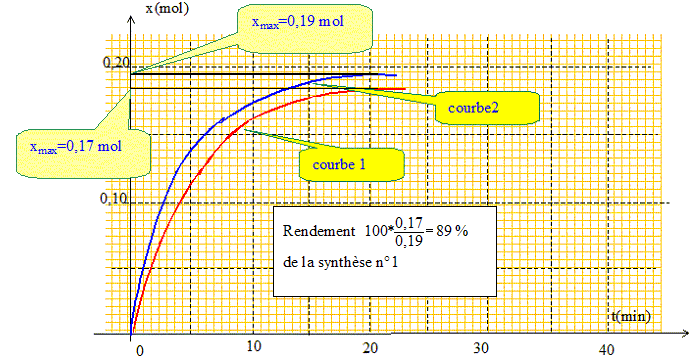
synthèse de l'arôme d'abricot : Pour cette synthèse de l'arôme d'abricot ( propanoate d'isoamyle) l'aide de laboratoire dispose d'un composé noté A, d'acide propanoïque, d'anhydride propanoïque et d'acide sulfurique. Afin de comparer les actions de l'acide propanoïque et de l'anhydride propanoïque sur le composé A, il réalise deux synthèses dans lesquelles le composé A ( qui sera le réactif limitant) est introduit en même quantité. Les courbes suivantes traduisent l'évolution de l'avancement chimique des synthèses 1 et 2 en fonction du temps. synthèse n°1 : acide propanoïque + composé A, présence d'acide sulfurique. Le propanoate d'isoamyle est obtenu par action de l'acide propanoïque sur le composé A. A partir de la formule développée du propanoate d'isoamyle, donner la formule semi-développée du composé A.
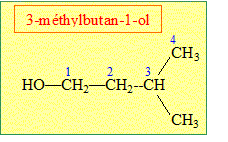
Préciser le nom systématique de ce composé.
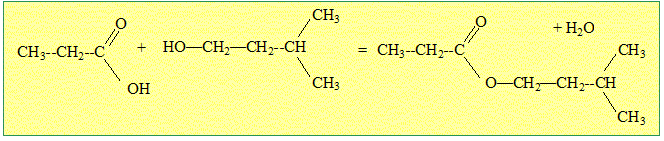
Ecrire l'équation de la réaction mettant en jeu le composé A et l'acide propanoïque en utilisant les formules semi-développées.
Nommer la transformation inverse qui est susceptible de se produire. Hydrolyse de l'ester.
Justifier l'emploi d'un
excès d'acide
propanoïque. En utilisant un réactif en excès,
on déplace l'équilibre vers la
droite, formation de l'ester. Le rendement sera
amélioré. Quel est le rôle
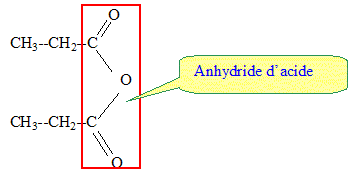
de l'acide sulfurique ? catalyseur. Encercler la fonction anhydride d'acide sur la formule développée de l'anhydride propanoïque. Ecrire l'équation de la réaction modélisant la synthèse n°2.
Quel est l'intérêt de l'emploi de l'anhydride propanoïque ? La réaction est totale. A partir de la courbe 2 déterminer graphiquement l'avancement maximal xmax de la transformation puis le rendement de la synthèse n°1.
On souhaite utilisé le choux
rouge comme indicateur coloré pour doser l'acide
propanoïque utilisé dans la synthèse de
l'arôme d'abricot. 3,0
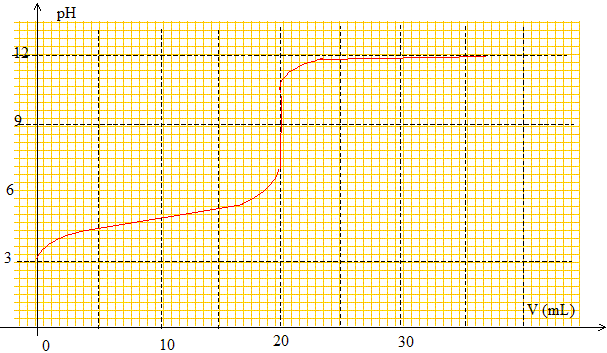
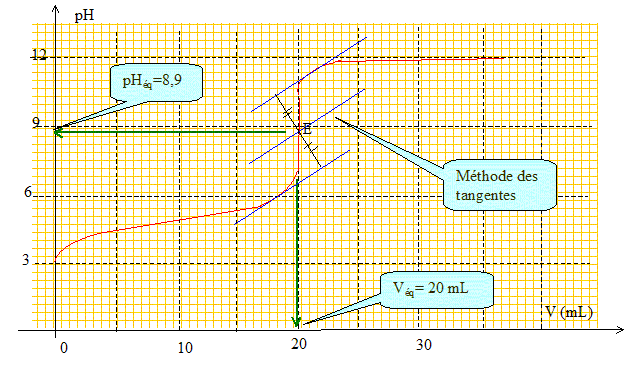
Ecrire l'équation bilan traduisant le titrage de l'acide propanoïque par l'hydroxyde de sodium (Na+(aq) + HO-(aq). CH3-CH2-COOH (aq) + HO-(aq) --> CH3-CH2-COO- (aq) + H2O (l) Déterminer graphiquement le volume V et le pH à l'équivalence.
Quelle couleur est la solution initiale une fois le choux rouge introduit ? La solution initiale a un pH voisin de 3 : la solution est donc rouge. Le chou rouge peut-il être utilisé comme indicateur coloré dans le dosage ? Justifier. Le pH à l'équivalence doit appartenir à la zone de virage de l'indicateur coloré. pHéq voisin de 9 ; la solution passeraît du bleu au vert vers pH=8,5. Le changement de teinte ne sera pas très net pour l'oeil. La solution passeraît du rouge au bleu entre pH =6 et pH=8,5. Le choux rouge peut convenir, faute de mieux !
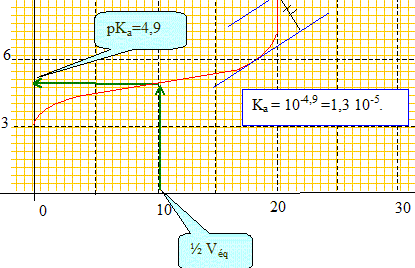
Donner alors l'expression de la constante d'acidité de l'acide propanoïque en fonction du pH lorsque la moitié du volume équivalent a été versé. à la demi équivalence de ce dosage : [CH3-CH2-COO-] = [CH3-CH2-COOH] en conséquence Ka = [H3O+] = 10-pH. Déterminer graphiquement la valeur de la constante d'acidité.
de l'arôme d'abricot est synthétisé à chaud à partir d'un volume VA=20,0 mL d'alcool noté A et d'un volume VB = 29,0 mL d'acide propanoïque en présence de 1,0 mL d'acide sulfurique. On note VT =50,0 mL le volume total du mélange.
La réaction chimique a pour équation : C2H5-COOH + C5H12O = C8H16O2 +H2O Afin de suivre l'évolution de cette transformation en fonction du temps, des prises d'essai de volume V'B=3,0 mL sont réalisées à intervalles de temps réguliers. Une trempe de chaque prise d'essai est effectuée dès son prélèvement : cette opération consiste à ajouter une grande quantité d'eau distillée glacée à la prise d'essai. Les acides ( sulfurique et propanoïque restant ) sont dosés par une solution d'hydroxyde de sodium de concentration C= 1,0 mol/L en présence de jus de choux rouge. Expliquer l'intérêt de la trempe en précisant le(s) facteur(s) cinétique(s) mis en jeu. La trempe réalise un blocage cinétique : la composition du mélange ne change plus. Le facteur cinétique mis en jeu est la température. Déterminer la quantité de matière d'acide propanoïque nB(0) introduite à la date t=0. masse (g) = masse volumique (g/mL) * volume (mL) m = 0,99 * 29,0 = 28,71 g quantité de matière (mol) = masse (g) / masse molaire (g/mol) nB(0) = 28,71 / 74,0 =
0,388 ; nB(0)
=0,39 mol.
La quantité de matière initiale d'alcool est nA(0) = 0,18 mol. Déterminer l'avancement maximal de la transformation chimique. L'alcool est le réactif limitant. En conséquence xmax = 0,18 mol. Etablir la relation entre la quantité nB d'acide restant à la date t, nB(0) et l'avancement x. nB = nB(0) - x. Dans le tableau suivant sont reportés les volumes de réactif titrant versés pour doser uniquement l'acide propanoïque :
Déterminer la quantité de matière n'B d'acide propanoïque présent dans la prise d'essai à la date t=30 min. A l'équivalence n'B= V C = 13,0 10-3 * 1,0 = 1,3 10-2 mol. En déduire la quantité nB d'acide propanoïque restant dans le milieu réactionnel de volume VT= 50 mL. nB= 1,3 10-2*50,0/3,0 = 0,22 mol. ( 0,2167 )
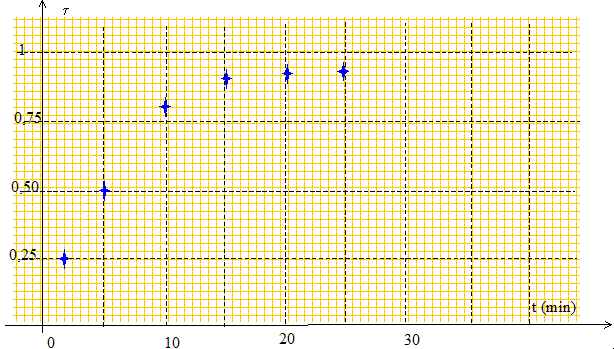
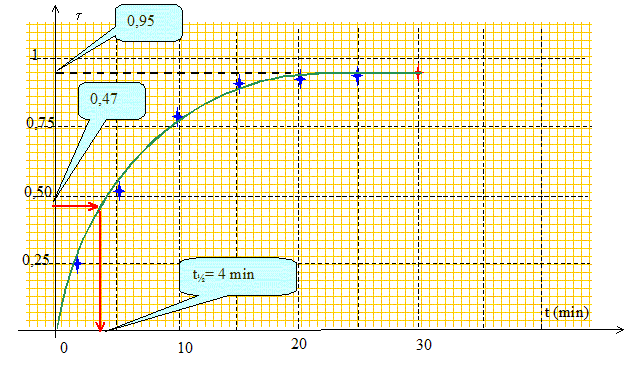
nB = nB(0) - x. x = nB(0) - nB = 0,388-0,2167 =0,171 mol t = x/xmax =0,171 / 0,18 = 0,95. Après avoir placé sur le graphe ci dessous la valeur déterminée à la question précédente, tracer la courbe.
Peut-on considérer que la transformation est terminée après 30 min de chauffage à reflux ? Justifier. Après 30 min de chauffage à reflux, la composition du mélange réactionnel ne change plus : la réaction est terminée. Définir et déterminer le temps de demi-réaction t½. Le temps de demi réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final. Le temps de demi réaction est la durée au bout de laquelle le taux d'avancement est égal à la moitié du taux d'avancement final.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||