|
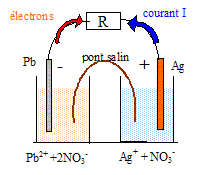
Etude d'une pile argent plomb, dosage des ions argent bac S 2007 Afrique |
|||
|
|||
|
On introduit dans un bécher (1) un volume V1 =100,0 mL d'une solution de nitrate de plomb (Pb2+(aq) + 2NO3-(aq)) de concentration en soluté apporté cl = 0,100 mol/L dans laquelle plonge une lame de plomb. Dans un second bécher (2), on verse un volume V2 = 100,0 mL d'une solution de nitrate d'argent ( Ag+(aq) +NO3-(aq)) de concentration en soluté apporté c2 = 0,100 mol/L dans laquelle plonge un fil d'argent. On dispose également d'un pont salin. On admet que la transformation chimique permettant à cette pile de fonctionner est décrite par la réaction: 2 Ag+(aq) + Pb(s) = 2 Ag(s)+Pb2+(aq). La constante d'équilibre associée à cette réaction est K = 6,8 1028.
La réaction se déroulant à l'électrode de plomb peut-être modélisée par : Pb = Pb2+ + 2e-. La pile fonctionne pendant une heure en fournissant un courant d'intensité constante I= 65 mA. Données : le faraday, valeur absolue de la charge d'une mole d'électrons 1 F = 9,65 104 C/mol ; nombre d'Avogadro : NA = 6,02 1023 mol-1. Charge électrique élémentaire e = 1,6 10-19 C.
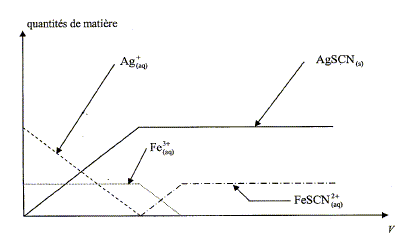
Quotient de réaction initial du système mis en jeu lors de la fabrication de la pile. 2 Ag+(aq) + Pb(s) = 2 Ag(s)+Pb2+(aq). Q r i = [Pb2+(aq)]i /[Ag+(aq)]i2 =c1/c22 = 1/c2 = 1/0,100 ; Q r i = 10,0. Le quotient initial Q r i est inférieur à la constante d'équilibre K : le système évolue spontanément dans le sens direct et la pile peut débiter un courant électrique. La réaction se déroulant à l'électrode de plomb peut-être modélisée par : Pb = Pb2+ + 2e-. (1) La pile fonctionne pendant une heure en fournissant un courant d'intensité constante I= 65 mA. Quantité d'électricité Q échangée pendant une heure d'utilisation : Q= I Dt avec I= 0,065 A et Dt= 3600 s. Q = 0,065*3,6 102 = 234 C. ( 2,3 102 C) Quantité de matière d'électrons ne échangée pendant cette durée. Q= ne F ; ne = Q/F =234/ 9,65 104 ; ne = 2,4 10-3 mol. Quantité de matière n(Pb2+) d'ions Pb2+(aq) formée pendant cette durée. D'après les coefficients de (1) : n(Pb2+) = ½ne ; n(Pb2+) = 1,2 10-3 mol. Concentration finale en ions Pb2+(aq) notée [Pb2+(aq)] dans le bécher (1). Quantité de matière des ions Pb2+(aq) dans le bécher (1) = quantité de matière initiale + quantité de matière formée n(Pb2+) totale = c1V1 + n(Pb2+) formé =0,1*0,1 +1,2 10-3 = 1,12 10-2 mol [Pb2+(aq)] = n(Pb2+) /V1 = 1,12 10-2/ 0,100 = 1,1 10-1 mol/L. Dosage des ions argent dans le bécher (2) On désire maintenant déterminer la valeur de la concentration finale en ions Ag+(aq), notée [Ag+(aq)]f, en réalisant le dosage des ions Ag+(aq) présents dans le bécher (2). Réflexions sur le protocole expérimental On dispose d'une solution contenant des ions Ag+(aq) et des ions Fe3+(aq), on ajoute progressivement à ce mélange une solution contenant des ions thiocyanate SCN- (aq). Les réactions possibles sont les suivantes: réaction (a) : Ag+(aq) +SCN- (aq) = AgSCN (s) ; le précipité formé est blanc. réaction (b) : Fe3+(aq) + SCN- (aq) = FeSCN2+(aq) ; le composé formé est rouge sang. Un logiciel permet de simuler les quantités de matière des espèces présentes dans la solution au fur et à mesure de l'ajout d'un volume V de solution de thiocyanate de potassium (K+(aq)) + SCN- (aq).
- une diminution de la quantité de matière d'ion Ag+(aq) - que la quantité de matière d'ion Fe3+(aq) reste constante. Après l'équivalence, le graphe montre que : - la quantité de matière d'ion Ag+(aq) est nulle - la quantité de matière d'ion Fe3+(aq) diminue. Les réactions (a) et (b) ne se déroulent pas simultanément : la réaction (a) se déroule en premier. L'équivalence de ce dosage est repérée par l'apparition de la couleur rouge sang due à l'ion FeSCN2+(aq). Ce titrage se déroule en une seule étape :
c'est un titrage direct.
A l'équivalence les quantités de matière de réactifs mis en présence sont en proportions stoechiométriques : Vp[Ag+(aq)]f = [SCN-(aq)] Veq. [Ag+(aq)]f = [SCN-(aq)] Veq / Vp = 2,0 10-1 *7,5 / 20,0 =7,5 10-2 mol/L. L'équilibre chimique est-il atteint ? Q r f= [Pb2+(aq)]f /[Ag+(aq)]f2 =1,12 10-1/(7,5 10-2)2 ; Q r f =20. Le quotient Q r f est inférieur
à la constante d'équilibre K : |
|||
|
|
|||
|
|