|
Précipitations sélectives des sulfures métalliques ( chimie ) |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
corrigé domaines de prédominance : 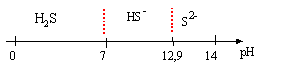
Expression de log[S2-] en fonction [H3O+] noté "h" et cs, concentration totale en espèces soufrées : H2S+H2O=HS-+H3O+ ; ka1 = [HS-][H3O+]/[H2S] (1) HS- +H2O=S2-+H3O+ ; ka2 = [S2-][H3O+]/[HS-] (2) conservation de l'élément soufre : cs = [H2S]+[HS-]+[S2-] (3) solution électriquement neutre : [HS-]+2[S2-] +[HO-]= [H3O+] (4) (1) s'écrit : [HS-]= ka1[H2S]/[H3O+] repport dans (2) : ka2 = [S2-][H3O+]²/( ka1[H2S]) ; [H2S]= [S2-][H3O+]²/( ka1ka2 ) (2) s'écrit : [HS-] = [S2-][H3O+]/ ka2 repport dans (3) : cs = [S2-][H3O+]²/( ka1ka2 ) + [S2-][H3O+]/ ka2 + [S2-] cs = [S2-] ( 1 + [H3O+]/ ka2 +[H3O+]²/( ka1ka2 ) ) cs = [S2-] ( 1 + h/ ka2 +h²/( ka1ka2 ) ) [S2-] =cs /(1 + h/ ka2 +h²/( ka1ka2 )) log [S2-] = log cs - log (1 + h/ ka2 +h²/( ka1ka2 )).
si pH <7 : 1+ 1013h négligeable devant 1020 h² d'où : log [S2-] = log 0,1 - log ( 1020 h²)= -1 -20 -2log h = -21 + 2pH si 7<pH<13 : 1+1020 h² négligeable devant 1013h d'où : log [S2-] = log 0,1- log ( 1013 h)= -1 -13 -log h = -14+pH. si pH>13 : 1013h + 1020 h² négligeable devant 1 : log [S2-] = log 0,1- log 1 = -1.
|
|||||||||||||||||||||||||||||||
|
On donne les produits de solubilité des sulfures métalliques : pKs(PbS) = 28 ; pKs(ZnS) = 22 ; pKs(FeS) = 17 ; pKs(MnS) = 10 .
corrigé La solubilité est d'autant plus grande que le produit de solubilité Ks est plus grand ou pKs =-log Ks plus petit. En effet : MS(s) =M2+ + S2- ; Ks= [M2+][S2- ] = s² soit s = Ks½. d'où le classement du plus soluble au moins soluble : MnS ; FeS ; ZnS ; PbS. Expression de la solubilité de MnS en fonction de [H3O+] : on pose [Mn2+] = s MnS(s) =Mn2+ + S2- ; Ks= [Mn2+][S2- ] = s [S2-] ; log Ks = log s + log [S2-] ; log s = log Ks - log [S2-] = - pKs- log [S2-] avec log [S2-] = log cs - log ( 1+ 1013h + 1020 h²) log s = - pKs-log cs + log ( 1+ 1013h + 1020 h²) Calcul de s à pH=7 : log s = - 10-log 0,1
+ log ( 1+ 106 + 106)=
-11+6,3 = -4,7 ; s = 2 10-5 mol/L
dés que le produit de solubilité est atteint, alors le solide MS apparaît ; de plus [M2+]0 = 10-4 mol/L Le précipité apparaît dès que [S2-] = Ks/10-4 soit log [S2-] = log Ks-log10-4 ; log [S2-]=-pKs+4 si pH <7 : log [S2-] = -21 + 2pH -pKs+4 = -21 + 2pH1 ; 2pH1 =25-pKs ; pH1 =12,5-½pKs . si 7<pH<13 : log [S2-] = -14+pH. -pKs+4
= -14 + pH1
; pH1
=18-½pKs .
[S2-] = Ks/10-6 soit log [S2-] = log Ks-log10-6 ; log [S2-]=-pKs+6 si pH <7 : log [S2-] = -21 + 2pH -pKs+6 = -21 + 2pH1 ; 2pH2 =27-pKs ; pH2 =13,5-½pKs . si 7<pH<13 : log [S2-] =-14+pH. -pKs+6
= -14 + pH2
; pH2
=20-½pKs .
|
|||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||