|
ozone : structure, moment dipolaire |
||||
|
||||
|
Les longueurs des liaisons dans la molécules d'ozone O3 valent 1,28 10-10 m.. Dans la molécule O2, la longueur de la liaison vaut 1,21 10-10 m. Dans la molécule H2O2, la longueur de la liaison O--O vaut 1,48 10-10 m.
L'angle prévu par cette théorie devrait être de 120°: mais le doublet non liant est plus volumineux que les deux doublets de liaisons : d'où un angle réel de 117°, inférieur à 120°. Il y a mésomérie
entre ces deux formes limites : en conséquence la longueur des liaisons est intermédiaire entre la longueur d'une liaison double ( molécule O2) et la longueur d'une liaison simple (molécule H2O2). L'atome d'oxygène central porte la charge partielle +2d ; les autres atomes d'oxygène porte chacun la charge -d.
Le moment dipolaire p s'exprime par : p = 2d e a cos (½a) avec : a : longueur (m) de la liaison ; e : charge élémentaire ; a = 117° angle entre les liaisons ; p ( C m) d'où d = p/(2e a cos (½a)) = 0,49 * 3,3356 10-30 / (2*1,6 10-19*1,28 10-10 * cos 58,5 ) = 0,076 ( 7,6 %)
|
||||
|
|

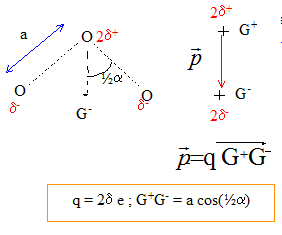 le moment dipolaire est dirigé vers le
barycentre des charges négative G-.
le moment dipolaire est dirigé vers le
barycentre des charges négative G-.