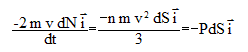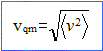|
Théorie cinétique des gaz : calcul de pression ( thermodynamique : concours CCP 02 ) |
||||
|
||||
|
Les principaux composants de l’air : N2 (78 % air sec) ; O2 (21% air sec) ; Ar (1 % air sec) ; l’eau ( proportion variable) ; CO2. gaz parfait : gaz constitué de particules suffisamment éloignées les unes des autres afin que leurs interactions soient très faibles, voir nulles. Dans ce cas, l’énergie potentielle d’interaction entre les molécules est négligeable devant l’énergie d’agitation thermique.( kT) Un gaz réel sous faible pression se comporte comme un gaz parfait. mélange idéal de gaz : chaque constituant se comporte comme s’il était seul dans tout le volume et à la température du mélange. On appelle pression partielle du constituant noté i la pression qu'il aurait s'il était seul dans tout le volume à la température du mélange.
Soit un gaz parfait constitué de N molécules identiques de masse m . On note P (Pa) sa pression, V (m3) son volume et T (K) sa température. L'équation d’état s'écrit : PV = NkT où k =R/NA = 8,314/6,022 1023 =1,38 1023 J K-1 est la constante de Boltzmann. On note n= N/V la densité volumique moléculaire ; la pression s'exprime par : P= n kT. On admet que les molécules ont des vitesses de même
module et que leurs vitesses Le nombre de molécules, noté dN qui heurtent une surface de la paroi d’aire dS pendant dt est compris dans un cylindre de base dS et de hauteur vdt ; de plus les vitesses de ces molécules doivent avoir la bonne direction : d'où dN= 1/6 n vdt dS. On suppose que le choc sur la paroi est élastique : la variation de la quantité de mouvement du gaz provoquée par ces chocs s'exprime par : pour une molécule : pour tout le gaz : d'où l'expression de la force exercée sur la paroi : P= 1/3 n m v2. Cette expression est exacte si on y remplace la vitesse
par la vitesse quadratique moyenne Expression de l’énergie cinétique moyenne d’une molécule : ½m <v2> ; or <v2> = 3P/(n m) et P= n k T d'où : ½m <v2> =1,5 kT. Pour le diazote dans les conditions normales de température et de pression (105 Pa et T= 273 K) : <v2> = 3 kT/m= 3RT/M = 3*8,314*273 / 28 10-3 = 2,43 105 soit <v> = 493 m/s.
|
||||
|
|