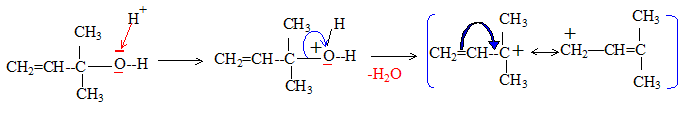|
CAPES physique chimie ( d'après concours 2006) quelques étapes de la synthèse du rétinal |
||||||
|
||||||
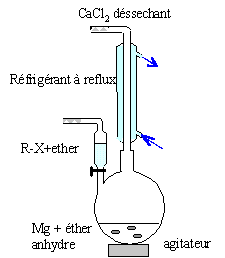
Le chimiste français Victot Grignard est célèbre pour avoir développé les réactifs organomagnésiens. Il a obtenu le prix Nobel en 1912. Equation de la réaction de synthèse du chlorure de vinylmagnésium : CH2=CHCl + Mg = CH2=CH-Mg-Cl
( solvant : THF anhydre) 2CH2=CH-Mg-Cl +2 H2O
= 2CH2=CH2 + MgCl2
+ Mg(OH)2.
d'où la structure semi-développée du produit A : CH2=CH-C(CH3)2OH Rôle de l'hydrolyse : L'intermédiaire de la réaction est : CH2=CH-C(CH3)2O-Mg-Cl Ce dernier donne par hydrolyse : CH2=CH-C(CH3)2OH + MgCl2 + Mg(OH)2. en milieu acide on
évite la précipitation de Mg(OH)2.
après hydrolyse, le mélange réactionnel est décanté, la
phase aqueuse est extraite par deux portions de 15 mL de solvant de la
réaction, les phases organiques sont réunies, séchées sur du sulfate de
sodium anhydre, filtées, puis évaporées : on isole ainsi le produit A
sous forme d'une huile.
L'extraction par solvants ( non miscibles avec l'eau) permet de récupérer la totalité du produit A. Le coefficient de partage k ne dépend que de la température et de la nature des solvants ; K est le rapport des concentrations molaires d'une espèce notée E dans deux phases aqueuse et organique non miscibles : k = [E]org / [E]aq . En utilisant une portion de volume Vorg= 30 mL, on obtient : k = norg Veau/ ( neau Vorg) avec norg + neau = constante = N En supposant, pour simplifier, Vorg=Veau il vient : norg = k neau ; k neau + neau =N neau =N/(k+1) et norg = kN/(k+1). si k=9 alors 90 % de l'epèce à extraire est dans la phase organique. En utilisant deux portions de volume ½Vorg=15 mL, on obtient : (en supposant, pour simplifier, Vorg=Veau) première extraction : k = n1 org Veau/ (0,5 Vorg n1 eau) = 2 n1 org Veau/ ( Vorg n1 eau) =2 n1 org / n1 eau avec n1 org + n1 eau = N n1 org= 0,5 k n1 eau ; 0,5 k n1 eau + n1 eau = N ; n1 eau = 2N/(k+2) et n1 org= kN/(k+2) seconde extraction : k = 2 n2 org Veau/ ( Vorg n2 eau) = 2 n2 org / n2 eau avec n2 org + n2 eau = n1 eau . n2 eau= 2/ k n2 org ; 2/ k n2 org + n2 org = n1 eau ; n2 org = (1+2/k) n1 eau =k /(2+k)n1 eau ; n2 org = 2kN /(2+k)2. n1 org+ n2 org = kN/(k+2) + 2kN /(2+k)2 = kN/(k+2) [1+2/(k+2)]=k(k+4)N/(k+2)2. norg =k(k+4)N/(k+2)2. si k=9 alors
97 % de l'epèce à extraire est dans la phase organique.
BrCH2-CH=C(CH3)2
(1) et CH2=CH-C(CH3)2Br
(2) passage au magnésien : BrMg-CH2-CH=C(CH3)2 action de l'organomagnésien sur le méthanal H2C=O ; il se forme un alcool primaire : HO-CH2-CH2-CH=C(CH3)2 action de HCl en milieu acide : Cl-CH2-CH2-CH=C(CH3)2
CH3-COOH + SOCl2 --> CH3-COCl + SO2(g) + HCl(g) Le chlorure d'acyle est beaucoup plus réactif que
l'acide carboxylique. Il faut travailler en milieu anhydre, sinon, en
présence d'eau, le chlorure d'acyle donne l'acide carboxylique.
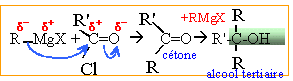
avec R' : CH3 et R : CH2-CH2-CH=C(CH3)2 Difficultés liées à cette réaction :
|
||||||
|
0 |
||||||
|
|
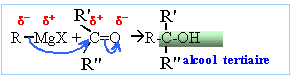 avec R'
=R" : -CH3 et R : CH2=CH-
;
avec R'
=R" : -CH3 et R : CH2=CH-
;