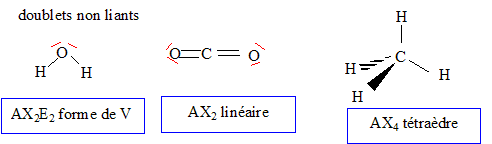|
CAPES physique chimie ( d'après concours 2006) Thermodynamique de la combustion du gaz naturel |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
CH4(g) + 2 O2(g) = CO2(g) + 2H2O(liq) (1) Structures moléculaires :
On donne les
enthalpies standart de formation à 298 K, en kJ mol-1.
Les configurations électroniques des atomes H, C et O : H : 1s1 ; C : 1s2 2s2 2p2 ; O : 1s2 2s2 2p4 ; Formules de Lewis pour les molécules d'eau, de dioxyde de carbone et de méthane : La géométrie de ces trois molécules dans le cadre de la méthode VSEPR
Aspects thermodynamiques : On donne les
enthalpies standart de formation à 298 K, en kJ mol-1.
L'enthalpie standard de formation du dioxygène gazeux à 298 K est nulle : Etat standard : état physique sous lequel un corps pur est le plus stable, sous la pression atmosphérique (1 bar) et à une température donnée. Enthalpie standard de formation : variation d'enthalpie accompagnant la formation d'une mole de composé à partir des éléments pris à l'état standard, à une température donnée, très souvant 298K. Par définition, l'enthalpie de formation d'un élément (carbone, soufre...) ou d'un corps pur simple (O2, H2...) dans l'état standard est nulle. Valeur de l'enthalpie standard de la réaction (1), notée DrH°1 : DrH°1 = DfH°(CO2) + 2DfH°(H2O) - 2DfH°(O2) - DfH°(CH4) DrH°1 =-393,5 + 2*(-285,8) -(-74,4) = -891 kJ mol-1. On considère une enceinte de volume V= 1,00 m3 de gaz naturel, assimilé à du méthane pur, gaz parfait pris à 298 K sous une pression p0= 1,00 bar. La quantité n de méthane contenue dans cette enceinte : la loi des gaz parfait s'écrit : p0V=nRT
soit n= p0V / (RT) = 105*1/(8,31*298)
= 40,4 mol. 40,4 * 891 = 3,6 104 kJ L'air sec est composé de 78 % de diazote, de 21 % de dioxygène et de 1 % d'argon Le volume d'air ( mélange de gaz parfait ontenant 20 % de dioxygène) nécessaire à la combustion de cette quantité n de méthane : CH4(g) + 2 O2(g) = CO2(g) + 2H2O(liq) (1) n(O2) = 2 n(CH4) = 2*40,4 = 80,8 mol. soit encore 2,00 m3 de dioxygène ; donc 10,0 m3 d'air. On appelle tep ( tonne équivalent pétrole) l'unité correspondant à l'énergie libérée par la combustion d'une tonne de pétrole à T=298 K sous la pressio p0. On donne 1 tep = 42 109 J. Masse de méthane dont la combustion dans les mêmes conditions peut libérer une énergie de 1 tep : 1 mole de méthane ( soit 16 g) libère 891 kJ ; 1 kg de méthane libèrera : 891*1000/16 = 5,57 104 kJ = 5,57 107 J 42 109 / 5,57 107
= 754 kg. La combustion du méthane peut également s'effectuer
suivant la réaction de combustion incomplète traduite par l'équation : - L'énergie libérée est inférieure ( environ 30%) par rapport à la combustion complète. - Dans l'habitat, le monoxyde de carbone est un gaz mortel d'autant plus difficile à détecter qu'il est incolore et inodore. |
||||||||||||||||||||||
|
0 |
||||||||||||||||||||||
|
|