|
CAPES physique chimie ( d'après concours 2006) Indicateurs colorés : pH-métrie et conductimétrie |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
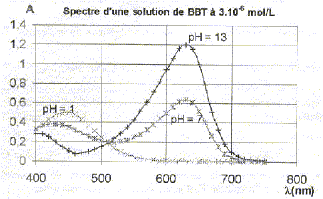
L'absorbance d'une solution de bleu de bromothymol à différents pH est donnée par le diagramme suivant :
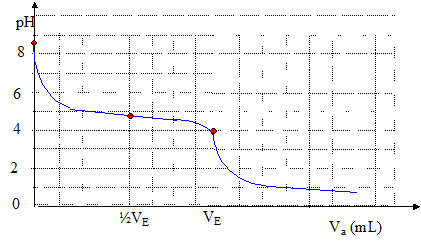
On envisage d'utiliser un indicateur coloré pour le dosage d'une solution d'acétate de sodium de volume V0= 200 mL et de concentration cb=1,00 10-2 mol/L par une solution d'acide chlorhydrique de concentration ca = 1,60 10-1 mol/L.
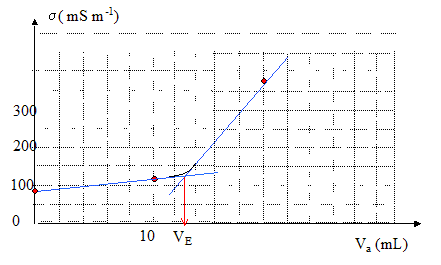
On se propose de réaliser le même dosage par une méthode conductimétrique.
Lorsqu'une lumière monochromatique d'intensité I0 traverse un milieu homogène, l'intensité de la lumière émergente I décroît exponentiellement lorsque l'épaisseur l du milieu absorbant augmente. I = I0 . e (- al) a est une constante appelée coefficient d'absorption, caractéristique du milieu et de la longueur d'onde considérés. Dans le cas des solutions, la loi de Beer fait intervenir les concentrations. I = I0 . e (- elc) où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1. La relation fondamentale utilisée en spectrophotométrie est présentée sous la forme : A= log (I0/I) = elc ( A est l'absorbance ou densité optique) e est une caractéristique de la molécule. Plus e sera grand, plus la solution absorbe. Absorbance et concentration étant proportionnelles,
cette relation peut être utilisée pour réaliser des dosages ou des
suivis cinétiques.
Le graphe donne A630 = 1,2 ; l = 1 cm ; c = 3 10-6 mol/L e=A/(lc) = 1,2 / (3 10-6 ) = 4 105 L mol-1 cm-1. La couleur des deux formes du bleu de bromothymol à pH=1 et à pH=13 : La couleur perçue par l'oeil est la couleur complémentaire de la teinte correspondant à d'absorption maximale : La forme acide a une teinte jaune ( absorption maximale à 450 nm, dans le bleu) La forme basique a une teinte bleue ( absorption maximale à 630 nm, dans le jaune orangé) Phénomène physique mis en jeu lors de l'absorption d'un photon de longueur d'onde 630 nm par la forme basique : effet bathochrome ou déplacement du maximum d'absorbance vers les grande longueurs d'onde : la forme basique possédant un système conjugué de grandes dimensions absorbe la lumière dans le jaune orangé. Calcul en joule et en eV, de l'énergie de ce photon : E= hc/l avec h = 6,62 10-34 J s ; c= 3,00 108 m/s ; l = 630 10-9 m. E = 6,62 10-34 *3 108
/ 630 10-9 = 3,15
10-19 J soit 3,15 10-19
/ 1,6 10-19 = 1,97
eV.
On envisage d'utiliser un indicateur coloré pour le dosage d'une solution d'acétate de sodium de volume V0= 200 mL et de concentration cb=1,00 10-2 mol/L par une solution d'acide chlorhydrique de concentration ca = 1,60 10-1 mol/L. Equation de la réaction de ce dosage : couples acide base : CH3-COOH / CH3COO- ; H3O+ / H2O CH3COO- + H3O+
= CH3-COOH + H2O à l'équivalence les quantités de matière (mol) d'acide et de base sont stoechiométriques. Avant l'équivalence, dans le becher, la base est en excès, après l'équivalence l'acide est en excès. caVéq = cbV0 ; Véq = cbV0 / ca=10-2*200/0,16 = 12,5 mL. Valeur du pH à la demi-équivalence : à la demi équivalence, la quantité de matière d'ion acétate restante est égale à la quantité de matière d'acide acétique formé : [CH3COO-]=[CH3-COOH] en conséquence pH= pKa(CH3-COOH
/ CH3COO- ) = 4,8. espèces majoritaires : CH3-COOH ; H2O ; H3O+. conservation de l'élément carbone : [CH3COO-]éq+[CH3-COOH]éq = cb ; [CH3-COOH]éq proche de cb . solution électriquement neutre : [Cl-]éq+[CH3COO-]éq + [HO-]éq= [H3O+]éq+[Na+]éq Or [Cl-]éq = [Na+]éq et [HO-] négligeable d'où [CH3COO-]éq = [H3O+]éq De plus Ka = [CH3COO-]éq [H3O+]éq / [CH3-COOH]éq ; [H3O+]2éq= Ka [CH3-COOH]éq ; [H3O+]2éq=10-4,8
* 10-2 = 10-6,8 ; [H3O+]éq
= 10-3,4 ; pH=
4. Calcul du pH initial : [CH3COO-] proche de cb ; ( réagit peu avec l'eau) CH3COO- + H2O = CH3-COOH + HO- ; d'où [CH3-COOH] = [HO-] = Ke/[[H3O+]] De plus Ka = [CH3COO-] [H3O+] / [CH3-COOH] =cb[H3O+]2/ Ke ; [H3O+]2= KaKe / cb = 10-16,8 ; pH= 8,4.
Dosage d'une solution d'éthanoate de sodium, suivi conductimétrique : On se propose de réaliser le même dosage par une méthode conductimétrique en utilisant un conductimètre. Ce appareil donne la conductivité de la solution en siemens mètre-1 ( S m-1) Equation de la courbe donnant la conductivité en fonction du volume Va d'acide ajouté :
Seuls les ions contribuent à la conductivité : [Na+] = V0cb/(V0+Va) avec cb= 10 mol m-3; [Cl-] = Vaca/(V0+Va) avec ca= 160 mol m-3 H3O+ réagissent totalement avec CH3COO- : [H3O+]=0 [CH3COO-]= (V0cb -Vaca) / (V0+Va) avec ca = 160 mol m-3. s = l°Na+ [Na+] + l°CH3COO-[CH3COO-] + l°Cl- [Cl-] = [l°Na+ V0cb + l°CH3COO-(V0cb -Vaca)+ l°Cl-Vaca] / (V0+Va) s = [(l°Na+ + l°CH3COO-) V0cb +(l°Cl-- l°CH3COO-Vaca]/ (V0+Va) =[9,1 10-3*2+(7,6-4,1 10-3)160Va]/ (0,2+Va) s =[1,82 10-2+0,56Va]/ (0,2+Va) après l'équivalence : acide en excès. [Na+] = V0cb/(V0+Va) avec cb= 10 mol m-3; [Cl-] = Vaca/(V0+Va) avec ca= 160 mol m-3 [H3O+] = (Va-VE)ca /(V0+Va) s = l°Na+ [Na+] + l°H3O+[H3O+]+ l°Cl- [Cl-] = [l°Na+ V0cb + l°H3O+(Va-VE)ca+ l°Cl-Vaca] / (V0+Va) s =[l°Na+ V0cb - l°H3O+VEca+(l°Cl-+ l°H3O+)Vaca] / (V0+Va) s =[5 10-3*0,2*10-35 10-3*0,0125*160 + 42,6 10-3*160Va] / (V0+Va) s =[-6 10-2 + 6,82Va] / (V0+Va).
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|