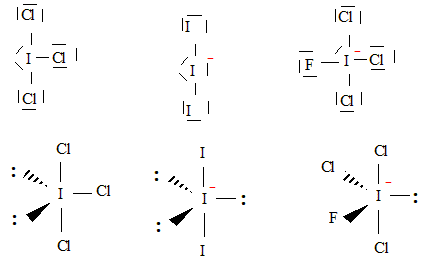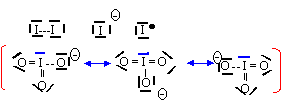|
CAPES physique chimie ( concours interne 2005 ) A propos de l'iode et de ces composés. |
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
corrigé configuration électronique de l'atome de diiode dans son état fondamental : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5. 7 électrons de valence ( 2 électrons 5 s et 5 électrons 5p), électrons de la dernière couche électronique occupée. 53-7 = 46 électrons de coeur. Au cours des réactions chimiques, seuls les électrons de valence entre en jeu. schéma de
Lewis de l'atome d'iode : L'énergie de première ionisation diminue en descendant un groupe : les orbitales électroniques s'expandent de plus en plus lorsque le nombre quantique principal n augmente. Les électrons de valence occupent une région de l'espace de plus en plus lointaine du noyau et seront donc plus faciles à arracher à l'élément. den conséquence F :
17,4 ; Cl : 13 ; Br : 11,8 ; I : 10,8.
en conséquence, le
difluor F2 oxyde le dichlore Cl2
en ClF3 et le dichlore oxyde le diiode en ICl3. Prévision du produit
de formation entre le dibrome et le diiode : IBr3.
ICl3 type AX3E2, forme d'un T, angles de 90 °. La molécule ICl3 est polaire : les atomes de chlore plus électronégatifs que l'atome d'iode attirent à eux les doublets de liaisons ; la géométrie de la molécule fait que le barycentre des charges négatives ne coïncide pas avec celui des charges positives ( situé sur l'atome d'iode). Schéma de Lewis et géomètrie des ions suivants : FICl3- d'atome central I et I3- : FICl3-
type AX4E ; I3-
type AX2E3, linéaire
L'ion IO3- est du type AX3E et a une structure pyramidale à base triangulaire avec des angles de liaisons de 104°.
|
||||||||||||||||||||||||||
La molécule de diiode n'est pas polaire ; l'eau est un solvant polaire : donc le diiode est peu soluble dans l'eau. Les solutions colorées présentent une longueur d’onde lumineuse où l’absorption est maximale. Cette longueur d’onde l max , choisie comme longueur d'onde de travail, ne dépend pas de la concentration, c’est une grandeur caractéristique de l’ion absorbant. Au préalable on doit déterminer cette longueur d'onde de travail en traçant la courbe de l'absorbance A en fonction de la longueur d'onde. la couleur de la solution est la couleur complémentaire de la couleur correspondant à la longueur d'onde de travail. Préparation d'un volume V= 20,0 mL d'une solution de diiode de concentration c= 5,0 10-4 mol/L à partir de la solution mère de concentration c0=2,0 10-3 mol/L. facteur de dilution F=c0= / c =2,0 10-3 / 5,0 10-4 =4 volume de la solution
mère à prélever à la pipette jaugée : volume de la fiole jaugée / F =
20 / 4 = 5,0 mL. L'absorbance est
proportionnelle à la concentration et à la largeur de la cuve ; Couleur de la solution de diiode dans le tétrachlorométhane : violet Cette teinte est diférente de celle d'une solution aqueuse de diiode : or la couleur correspondant à la longueur d'onde du maximum d'absorption est complémentaire de la teinte perçue par l'oeil. La mesure de
l'absorbance de la solution de I2 dans CCl4
s'estdonc faîte avec une longueur d'onde différente de celle de la
question précédente. utiliser de l'empois d'amidon qui donne une couleur violette, noire en présence de diiode. Concentration du diiode [I2]H2O dans la phase aqueuse : I2 + 2S2O32- = 2I- + S4O62-. à l'équivalence, n(I2 ) =½n(S2O32-) = ½CVE = 0,5* 1,24 10-2 *13,7 10-3 = 8,5 10-5 mol [I2]H2O
= n(I2 ) / V0
= 8,5 10-4 mol/L Solubilité sorg du diiode dans le tétrachlorométhane : saq / sorg = Kp(I2) sorg =saq /Kp(I2) = 1,36 10-3 * 7,4 10-2 / 8,5 10-4 =1,18 10-1 mol/L ( 87 fois plus importante que dans l'eau) On ne peut pas déterminer la concentration du diiode dans CCl4 par le même dosage que celui décrit précédemment car le thiosulfate de sodium est insoluble dans CCl4 ; de plus CCl4 est non miscible avec l'eau.
|
||||||||||||||||||||||||||
|
|