|
Agrégation physique chimie ( concours 2006 ) : pile à combustible à membrane échangeuse d'ions
|
||||
|
||||
|
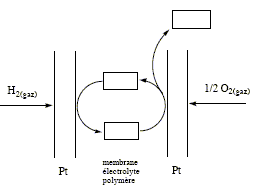
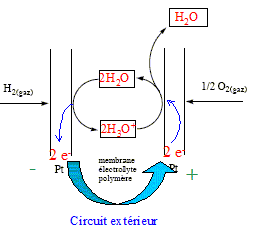
La pile à combustible est un système électrochimique convertissant en énergie électrique l'énergie chimique d'un combustible gazeux ( ici H2) en l'oxydant par le dioxygène pur ou le dioxygène de l'air. Une cellule de pile se compose de deux électrodes entre lesquelles est disposée une membrane électrolyte polymère. La température de fonctionnement est comprise entre 60 et 90°C, afin que la membrane conserve ses capacités de rétention d'eau. Les électrodes sont des très petites particules de platine ( 2 à 3 nm) supportées par des poudres de carbone. Etude de la réaction dans la cellule :
|
||||
|
||||
|
corrigé A l'anode, le dihydrogène s'oxyde : H2 + 2H2O ---> 2H3O+ + 2e-. Des électrons sont libérés dans le circuit extérieur ; cette électrode constitue la borne négative de la pile. A la cathode, le dioxygène se réduit : ½O2 + 2H3O+ + 2e- ---> 3H2O bilan : H2 +½O2 ---> H2O
Le facteur de conversion de la pile : Le système reçoit l'énergie thermique dQ=TdS ( cas de la réversibilité), le travail des forces de pression dW=-PdV et fournit l'énergie électrique dWélec à l'extérieur. Le premier principe de la thermodynamique s'écrit : dU= dW - dWélec + dQ =-PdV - dWélec + TdS à pression constante l'enthalpie s'écrit : dH= dU+PdV = - dWélec + TdS à température constante l'enthalpie libre s'exprime par : dG= dH-TdS = - dWélec Le rendement thermodynamique de la cellule ( r = -dWélec / (-dWélec+dQ) = dG / dH =DrG1dx/ DrH1dx= r ) est égal au facteur de conversion de la pile. Calcul du rendement : DrG1 = DrH1-T DrS1 = -285,8 103-353 (-163,2)= -228,2 kJ/mol ; DrH1= -285,8 kJ/mol ; r = 228,2 / 285,8 = 0,8 cette valeur est très élevée, comparée au rendement des moteurs thermiques ( 0,3). Calcul de la fem de la cellule : DrG1 = -nFE avec n = 2 (H2 + 2H2O ---> 2H3O+ + 2e- ) E=- DrG1 /(2F) = 228,2 103 / (2*96500) = 1,18 V. Ecart avec la valeur calculée : La pile possède une résistance interne r ; d'où une chute de tension ( U= E-rI) lors du fonctionnement. On peut minimiser r en choisissant un électrolyte de grande conductivité électrique. On peut observer une surtension aux électrodes : Le couple H3O+ /H2 est lent ; l'oxydation de H2 ne s'effectue avec une vitesse suffisante qu'à partir d'une certaine valeur de la tension ( surtension ). Celle-ci dépend du type de l'électrode. Avec le platine la surtension est la plus faible. Combien faut-il associer en série de cellules d'une surface efficace S= 250 cm² pour obtenir une puissance de 75 kW nécessaire au fonctionnement d'un moteur électrique ? On note n le nombre de cellules associées en série ; la tension aux bornes de l'ensemble est U= nEréelle = 0,7 n. L'intensité du courant est I= Sj = 250*0,5 = 125 A La puissance électrique est P= UI= 0,7 *125 n =87,5 n =
75 000 wats d'où n = 857. Quantité d'électricité ( coulomb) : Q= It = jSt = 0,5*250*3600 = 4,5 105 C La valeur absolue de la charge électrique d'une mole d'électrons vaut 96500 C ; d'où la quantité de matière d'électrons ne= 4,5 105 /96500 = 4,66 mol Quantité de matière de dihydrogène : (H2 + 2H2O ---> 2H3O+ + 2e- ) soit nH2=½ne=2,33 mol mH2 =nH2 M(H2) = 2,33*2 = 4,66 g. masse de dihydrogène consommée par 857 cellules : 857*4,66 = 4 kg.
|
||||
|
|